奥雷巴替尼获批进入倒计时,为亚盛医药-B(06855)估值增长打上一针“强心剂”
继11月5日,亚盛医药-B(06855)宣布其上市进度最快的重磅产品——奥雷巴替尼的临床进展连续第四年入选ASH年会口头报告后,这款重磅新药的国内上市进程也来到关键阶段。
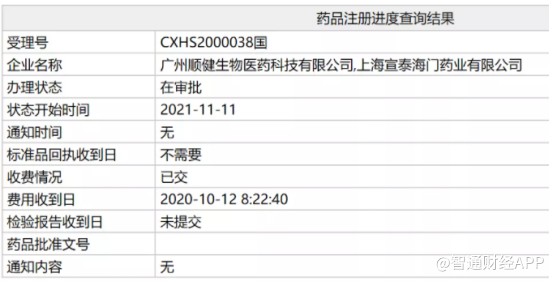
智通财经APP了解到,近日,中国国家药监局(NMPA)官网最新公示显示,由亚盛医药全资子公司顺健生物申报的1类新药——奥雷巴替尼(HQP1351,曾用名耐克替尼、奥瑞巴替尼)新药上市申请的审评审批状态已更新为“在审批”。这也意味着,该产品即将在近期正式获批上市。
作为一款针对格列卫耐药研发的第三代Bcr-Abl/KIT抑制剂,奥雷巴替尼是亚盛医药在研原创1类新药,是中国首个第三代BCR-ABL靶向耐药CML治疗药物,对BCR-ABL以及包括T315I突变在内的多种BCR-ABL突变体有突出效果。
回顾奥雷巴替尼的研发路程,自2020年以来,亚盛医药始终在奥雷巴替尼的上市进程上稳步推进,并不断取得重要阶段性成果。
去年6月18日,亚盛医药宣布公司已向国家药监局新药审评中心(CDE)提交奥雷巴替尼的新药上市申请,用于治疗伴有T315I突变的慢性髓性白血病(CML)慢性期和加速期患者。
值得注意的是,在国内正式进行上市申请前,奥雷巴替尼I期研究初步结果便曾在2018年ASH年会入选口头报告,2019年其更新临床数据则再次入选ASH年会口头报告。
而在2020年,奥雷巴替尼于5月相继获得了FDA孤儿药资格认定和快速通道资格(FTD);同年10月,奥雷巴替尼被CDE纳入优先审评,用于治疗TKI耐药后并伴有T315I 突变的CML慢性期或加速期的成年患者:同年12月,奥雷巴替尼的临床试验进展第三次入选ASH年会口头报告。
从今年以来的新药上市进展来看,3月30日,奥雷巴替尼正式被国家药监局新药审评中心(CDE)纳入“突破性治疗品种”公示名单。这是奥雷巴替尼继去年10月获得CDE授予的优先审评资格之后的又一重大进展。
今年7月,亚盛医药则与信达生物达成一项高达2.45亿美元的战略合作。作为合作内容之一,双方将在中国大陆、香港、澳门及台湾地区联合开发及商业化奥雷巴替尼。
而就在最近的11月5日,亚盛医药宣布,公司共有三个在研新药(奥雷巴替尼、APG-2575、APG-1252)的六项研究进展入选第63届美国ASH年会口头报告和壁报展示。值得一提的是,作为亚盛医药上市进度最快的重磅产品,奥雷巴替尼的临床进展已连续第四年入选ASH年会口头报告,充分显示了国际血液学界对其疗效和安全性的认可。
此外,亚盛医药已在生产端和销售端逐步建立起全面的商业化体系,而与信达生物达成的合作,则能够帮助公司加快组建本公司的血液学销售团队,助力奥雷巴替尼上市后快速完成在各级医院和药房的多层次覆盖,造福更广泛的中国患者。
可见,在业务发展层面,亚盛医药始终稳扎稳打,在奥雷巴替尼研发领域稳步推进。如今随着奥雷巴替尼的审评状态来到“在审批”阶段,这款新药也来到了获批上市的关键性节点,其未来市场潜力也预计将在其上市后转化为公司估值的真金白银。




 扫码下载智通APP
扫码下载智通APP