全球首个!信达生物(01801)和驯鹿生物共同开发的CAR-T产品自身免疫适应症申报临床
智通财经APP获悉,5月28日,据CDE官网公示,驯鹿生物递交的伊基仑赛注射液的临床试验申请获得受理。伊基仑赛注射液(商品名:福可苏)是由驯鹿生物和信达生物(01801)联合开发的一款全人源BCMA嵌合抗原受体自体T细胞注射液。据公司新闻稿显示,本次申报的适应症为抗体介导的视神经脊髓炎谱系疾病(NMOSD)。这是全球首个CAR-T在NMOSD疾病领域的IND申请。
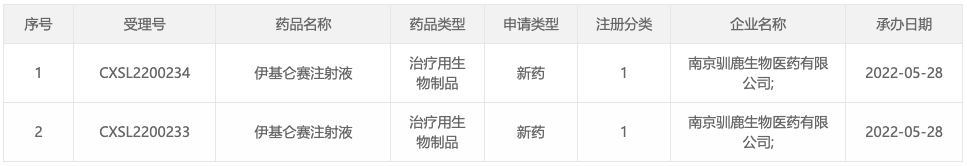
伊基仑赛注射液(商品名:福可苏)是由驯鹿生物和信达生物(01801)联合开发的一款全人源BCMA嵌合抗原受体自体T细胞注射液。该产品以慢病毒为基因载体转染自体T细胞,CAR包含全人源scFv、CD8a铰链和跨膜、4-1BB共刺激和CD3ζ 激活结构域。
2021年2月,CT103A已获得CDE(突破性治疗药物)认定,用于治疗复发/难治性多发性骨髓瘤。约一年后,再次获得FDA授予的孤儿药资格认定,用于治疗复发/难治性多发性骨髓瘤。
而本次申报的适应症为抗体介导的视神经脊髓炎谱系疾病(Neuromyelitis Optica Spectrum Disorder,NMOSD)。该项申请是基于伊基仑赛注射液研究者发起的临床研究(Investigator Initiated Trial,IIT),研究入组的受试者为至少使用一种免疫抑制剂治疗一年以上,但症状控制欠佳的难治性视神经脊髓炎谱系疾病患者。
该研究的主要目的是观察伊基仑赛注射液治疗 NMOSD 受试者的安全性、耐受性,以及初步的疗效、药代动力学(Pharmacokinetics,PK)、药物动力学(Pharmacodynamics,PD)相关指标。截至3月20日,12例受试者接受了伊基仑赛注射液回输,其中0.5×106 CAR-T 细胞/kg剂量组3例受试者、爬坡阶段与扩展阶段1.0×106 CAR-T 细胞/kg 剂量组分别3例和6例受试者接受了伊基仑赛注射液CAR-T胞回输。




 扫码下载智通APP
扫码下载智通APP