破晓已现,国内CAR-T 产品陆续开启产业化进程
本文来源中泰证券研报,作者为分析师江琦。
核心观点:我们认为随着《细胞治疗产品研究与评价技术指导原则》正式落地,海外CAR-T产品上市逐步临床应用,2018年将是国内CAR-T产品陆续开启产业化进程的第一年。多个CAR-T产品陆续获批临床推进进度,重点关注复星医药、药明康德、金斯瑞生物科技、安科生物等企业。
CAR-T产品海外成功上市,新技术价值得到认可。2017年8月31日和10月18日FDA分别快速批准了两款CAR-T细胞产品上市,分别是诺华的Kymriah(治疗r/rALL,后拓展至DLBCL)和KitePharma(后被Gilead收购)的Yescarta(治疗DLBCL、PMBCL)。
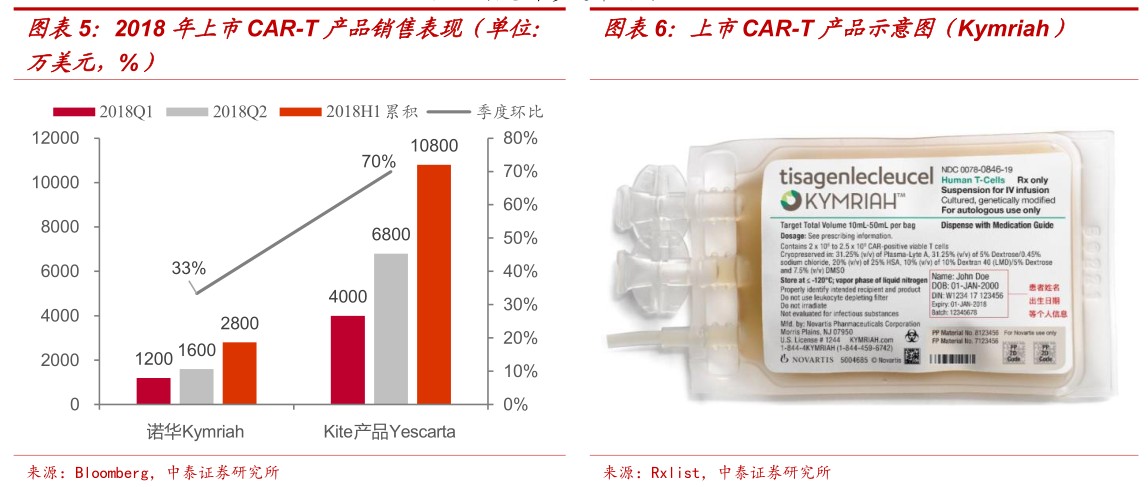
CAR-T产品从申报上市到获批历时仅6个月左右、速度超乎想象,我们认为疗效价值获得认可。虽然受制于研发和生产难度(自体使用,制备失败率)定价较高,Kymriah和Yescarta定价分别为47.5万美元和37.3万美元。但医保仍然较为认可。美国医疗保险与医疗服务中心CMS将CAR-T纳入报销体系,包括基本支付3.6万美元和最大NTAP(新技术附加付款)18.65万美元。Kymriah2018Q1和2018Q2销售额分别为1200万美元和1600万美元,季度环比增长约33%。Yescarta在2018Q1和2018Q2分别实现销售额4000万美元和6800万美元,季度环比增长70%。2018年上半年两个产品累积销售过亿美元,我们预计渗透率已达约3%-6%。
与市场观点不同,我们认为CAR-T作为平台型技术价值大,长期适应症有。望扩展、市场空间大。(1)由于环境变差、人口老龄化加剧等原因,中国癌症发病率和死亡率在近年来逐步攀升,肿瘤用药特别是中后期用药市场大。2011年我国新增癌症病例约337万例,比2010年增加28万例;死亡人数约211万;预计2015年中国癌症发病人数达到429.2万人、死亡人数281.4万人。(2)虽然目前CAR-T仅获批血液瘤,但CAR-T细胞疗法在实体瘤治疗上陆续有许多科学突破在逐步发现,也有多项临床研究在推进,我们认为随着技术进步CAR-T有望攻克更多实体肿瘤。(3)CAR-T到细胞疗法在中国血液瘤治疗市场空间就有望达到58亿元。假设新发病人30%使用CAR-T疗法,绝大多数死亡患者均属于目前疗法失效的复发难治患者、50%使用率,治疗费30万/人计算,我们认为30%渗透率下市场空间有望达到58亿。
整顿后步入正轨、海外技术助力,看好国内CAR-T细胞行业发展。2016年起国内医药巨头陆续通过和海外成熟CAR-T产品公司合作,将CAR-T产品引入国内。2017年12月22日,CFDA出台《细胞治疗产品研究与评价技术指导原则》(试行)。2018年南京传奇、上海明聚生物、上海恒润达生等多家企业陆续获批进入临床,我们认为2018年国内产业化陆续开启。看好具备技术领先优势的企业,建议关注复星医药(02196)、药明康德、金斯瑞生物科技(01548)、安科生物等。
风险提示:CAR-T疗法临床效果不及预期风险,国内CAR-T审批和管理的政策风险,企业研发进展不及预期风险。
以下为研报原文:
CAR-T产品海外成功上市,新技术价值得到认可
诺华和和KiteCAR-T产品在2017年先后获批上市
诺华和KiteCAR-T产品虽历经波折仍在在2017年先后获批,速度超前。作为目前肿瘤疗法中最具突破性的一种治疗手段,CAR-T细胞疗法临床表现优异。虽然由于技术上的原因目前在副作用和适应症上有一定限制、研发过程较为曲折。但凭借其显著疗效,FDA分别在2017年8月31日和10月18日快速批准了两款CAR-T细胞产品上市,分别是诺华的Kymriah(治疗r/rALL,后拓展至DLBCL)和KitePharma(后被Gilead收购)的Yescarta(治疗DLBCL、PMBCL)。CAR-T产品从申报上市到获批历时仅6个月左右,速度超乎想象。
诺华Kymriah:2017年8月31日FDA批准了诺华的CAR-T细胞产品Kymriah用于25岁以下青少年难治或复发急性淋巴细胞白血病(r/rALL)。2018年5月2日,FDA通过了Kymriah的第二个应用症,用于治疗先前接受过两次或以上的系统治疗的复发或难治性大B细胞淋巴瘤的成人患者(DLBCL)。2018年8月,KymriahALL和DLBCL两个适应症同时在欧洲获批上市。
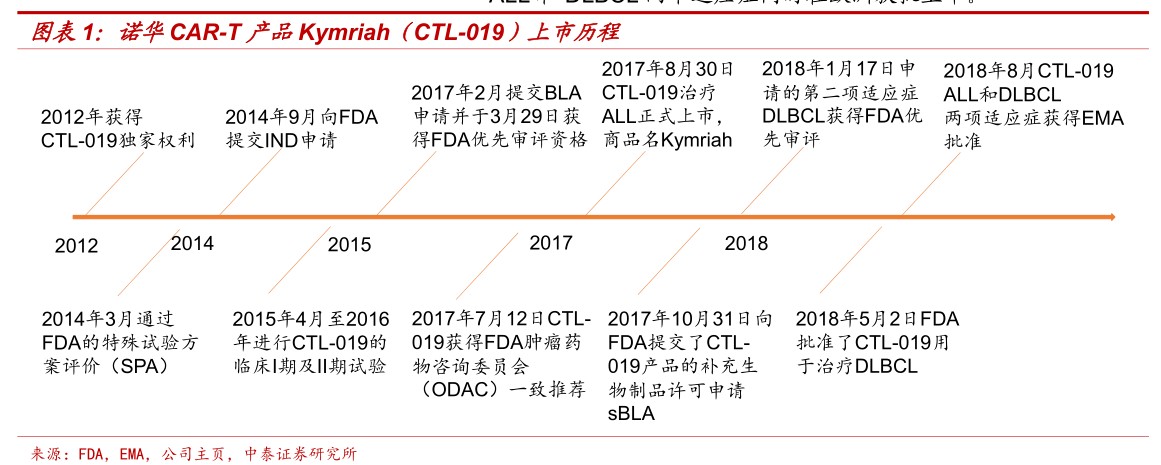
Kite产品Yescarta:2017年10月18日,FDA批准KitePharma的CAR-T细胞产品Yescarta(axicabtageneciloleucel,KTE-C19)上市,用于治疗复发/难治性大B细胞淋巴瘤的成人患者(DLBCL)。2018年8月,Yescarta用于治疗复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)和原发性纵隔大B细胞淋巴瘤(PMBCL)两个适应症同时在欧洲获批上市。

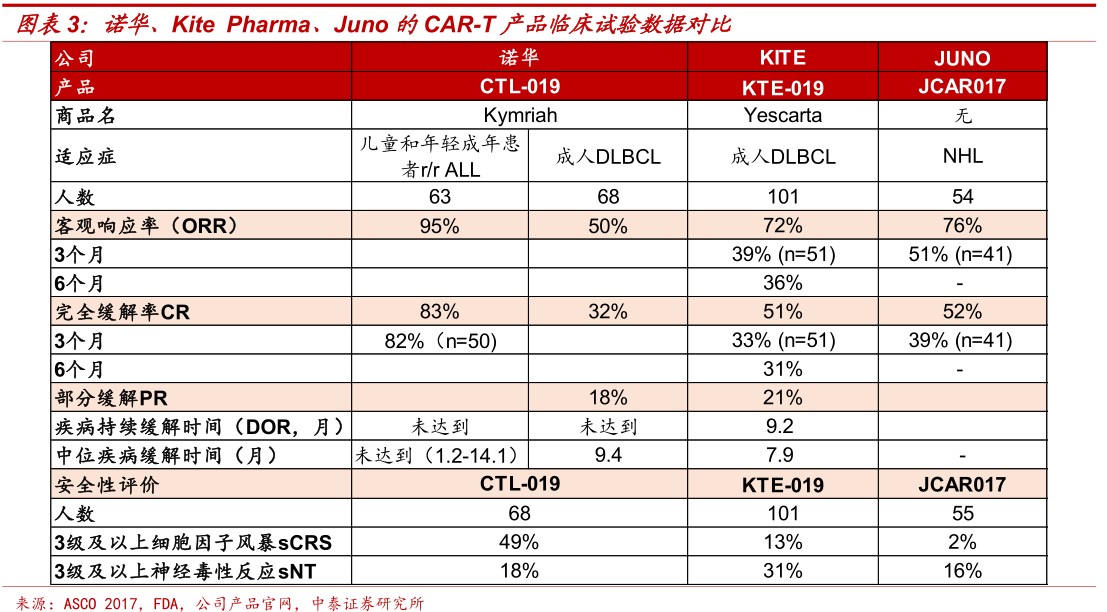
CAR-T细胞产品在血液瘤复发难治晚期病人身上展现了极其显著的治疗效果。以Kymriah(tisagenlecleucel,CTL019)为例,在复发难治急性淋巴细胞性白血病(ALL)病人身上客观响应率高达95%,完全缓解率达到83%。Kite的Yescarta(KTE-019)在治疗复发/难治性大B细胞淋巴瘤的成人患者上客观响应率达到72%,完全缓解率达到51%。
累积销售过亿美元,新疗法疗效获认可商保有望逐步纳入
CAR-T产品定价相对较高,研发和生产是主要壁垒。目前已上市的两个CAR-T产品受制于研发和生产难度(自体使用,制备失败率)定价较高,Kymriah和Yescarta定价分别为47.5万美元和37.3万美元。两者在不同适应症上使用剂量上略有差异。
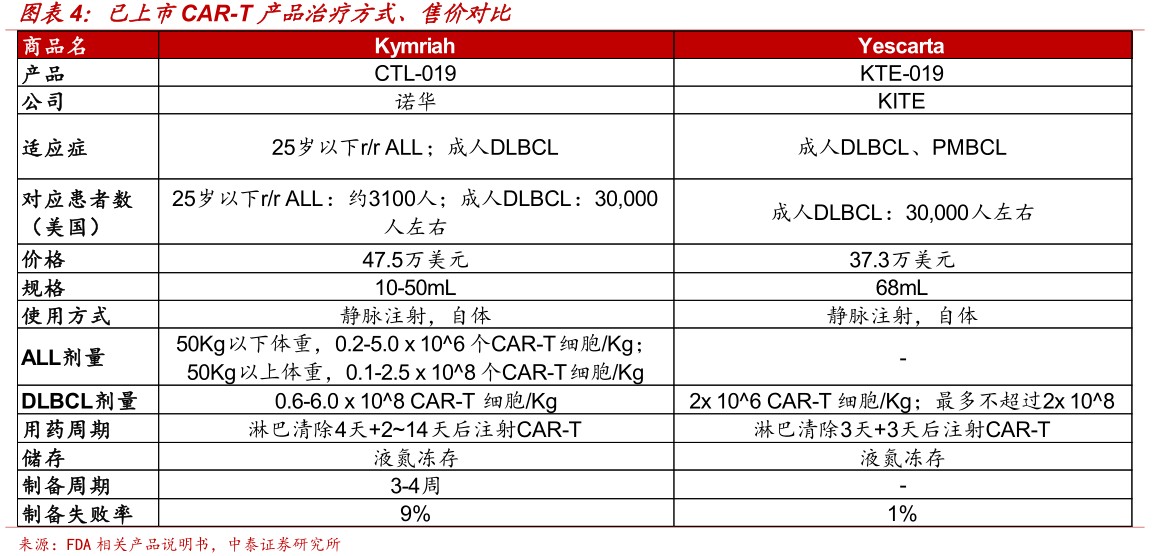
2018年上半年两个产品累积,销售过亿美元,我们预计渗透率约3%-6%。Kymriah2018Q1和2018Q2销售额分别为1200万美元和1600万美元,季度环比增长约33%。Yescarta在2018Q1和2018Q2分别实现销售额4000万美元和6800万美元,季度环比增长70%。由于首个获批的适应症对应患者数差异较大,二者销售额短期差异较大。两个产品累积销售金额达到1.36亿美元,对应治疗人数分别约58人和289人,获批适应症晚期患者渗透率约为3%-6%左右。
虽然价格相对较高,但疗效获得认可、商保有望逐步纳入。2018年4月8日,美国医疗保险与医疗服务中心(CMS)同意将CAR-T治疗费用纳入医保B,通过医疗保险为某些残障人士、晚期肾癌患者或65岁以上患者支付近80%的医疗费用,患者承担20%左右的治疗费用。CMS对于接受吉利德CAR-T治疗的患者向医院支付40万美元、为接受诺华CAR-T治疗支付50万美元的医疗保险。中小型商业保险公司Optum等也存在对Kite旗下CAR-T产品Yescarta的报销支持。2018年8月CMS公布了2019年的最终住院预期支付系统(IPPS),其中包括CAR-T治疗的报销。自2018年10月1日起,CAR-T将归类到MS-DRG016——自体骨髓移植与CC/MCC或T细胞免疫疗法,包括基本支付3.6万美元和最大NTAP(新技术附加付款)18.65万美元。诺华、Gilead甚至后续有望有产品获批上市的Celgene(Juno)有望积极争取更多保险对CAR-T产品的支持,我们认为依靠确切疗效商业保险有望逐步接入。
重视平台型技术的价值,长期适应症有望扩展、市场空间大
中国肿瘤发病率和死亡率逐步上升,肿瘤后期用药市场刚需大
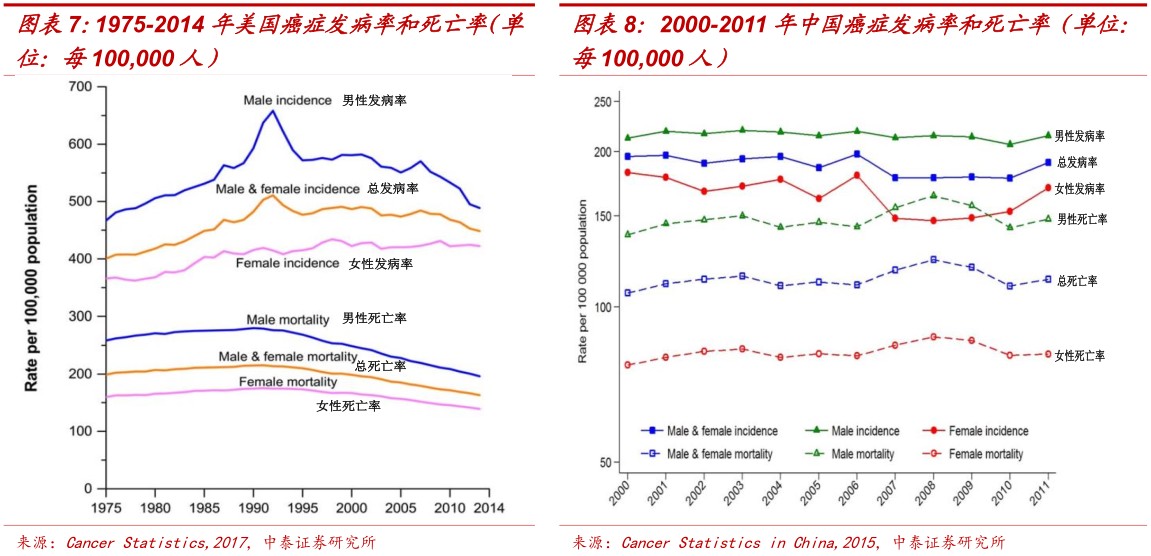
中国肿瘤发病率和死亡率不断上升,肿瘤后期用药市场刚需大。美国每十万人中肿瘤新发病率呈现上升趋势,从1973年的300/10万人上升到2014年的450/10万人左右,平均222人中就有一人新患癌症。近10年随着控制吸烟、推广癌症筛查和应用新型疗法癌症发病率和死亡率逐年下降。2014年癌症总发病人数168.88万人,死亡人数60.09万人。中国的情况则不同,2011年我国新增癌症病例约337万例,比2010年增加28万例;死亡人数约211万。2011年癌症总体发病率约200/10万人左右。预计2015年中国癌症发病人数达到429.2万人、死亡人数281.4万人。由于环境变差、人口老龄化加剧等原因,中国癌症发病率和死亡率在近年来逐步攀升,肿瘤用药特别是中后期用药市场大。
破晓已现,作为平台型技术CAR-T有望攻克更多实体肿瘤
n破晓已现,随着技术逐步取得进展术平台型技术CAR-T有望攻克更多实体肿瘤。CAR-T细胞疗法在血液瘤上展示了非同一般的效果,但目前面对实体瘤还需要克服实体瘤复杂肿瘤微环境、寻找更好的特异性肿瘤抗原、降低副作用等。值得欣喜的是,陆陆续续有许多科学突破在逐步发现,我们认为随着技术进步有望攻克更多实体肿瘤。
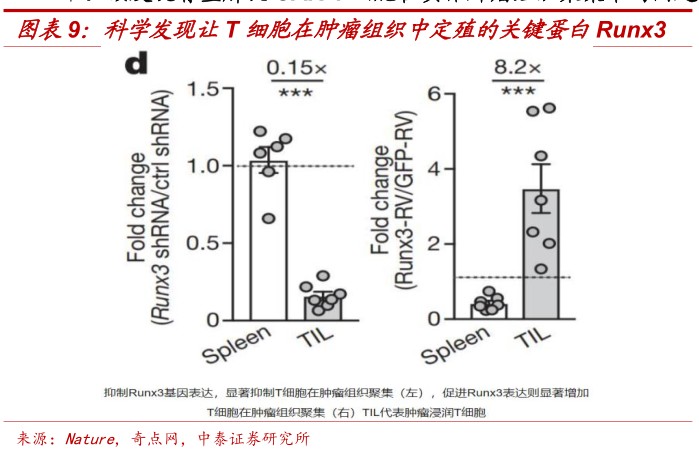
Ø美国加利福利亚大学圣地亚哥分校的Goldrath教授与来自斯克里普斯的Pipkin教授合作发现驱动T细胞离开淋巴组织聚集在外周以及肿瘤组织中的关键—Runx3蛋白。在小鼠体内证明,增加这一基因的表达可以显著增强过继性T细胞在实体瘤中的聚集增强治疗效果。该发现有望解决CAR-T细胞在实体肿瘤组织聚集难的问题。
《ScienceTranslationalMedicine》刊登了一项利用CART-EGFRvIII细胞对10名难治性/复发性胶质母细胞瘤患者进行CAR-T治疗的研究。结果表明,CART-EGFRvIII细胞具有可接受的安全性,能够穿过血脑屏障浸入肿瘤并引发免疫响应,从而使得胶质母细胞瘤细胞中的EGFRvIII肿瘤抗原减少。
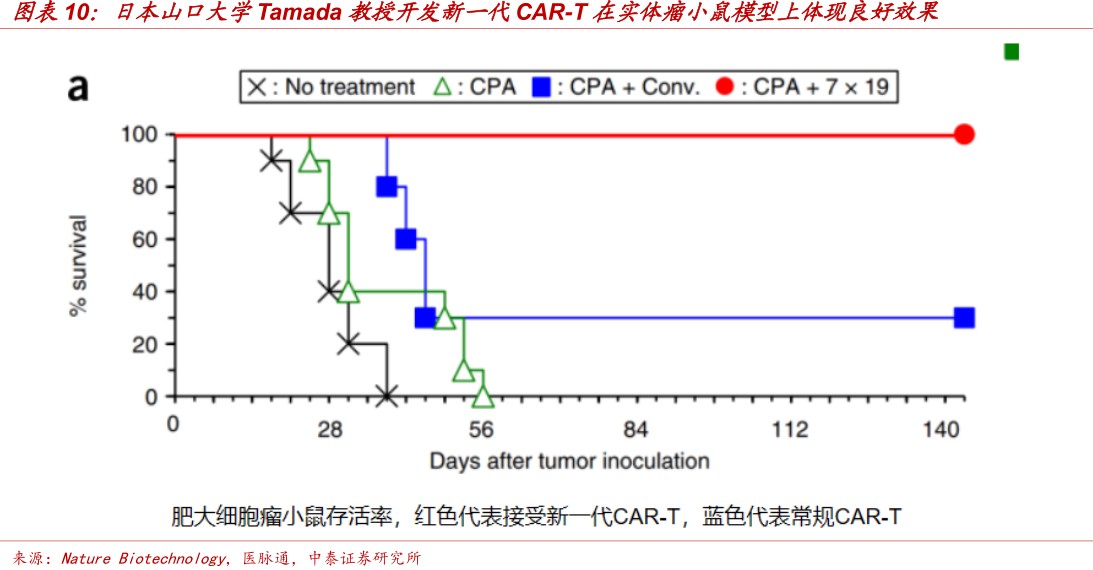
Ø日本山口大学Tamada教授开发新一代CAR-T,在常规CAR-T基础上进行改造使其表达IL7和CCL19两种趋化因子。在多种实体瘤小鼠模型中,全新CAR-T治疗实体瘤的效果是目前常规CAR-T的至少4倍,对于常规CAR-T几乎无效的实体瘤新一代CAR-T也能实现肿瘤的完全消除。全新一代CAR-T还解决了常规CAR-T治疗后易复发的难题。
多项人体临床试验正在对逐步开展,对CAR-T细胞疗法攻克更多肿瘤保持期待。随着基础研究陆续取得进展,多项针对CAR-T治疗肝癌、胃癌、胰腺癌、乳腺癌等实体肿瘤的临床试验正在开展,并且逐年增多。
中国CAR-T细胞疗法仅血液瘤市场空间有望达到58亿
CAR-T细胞疗法在中国血液瘤治疗市场空间就到有望达到58亿。2015年预计中国淋巴瘤和白血病死亡人数合计达到10.55万人。假设绝大多数死亡患者均属于目前疗法失效的复发难治患者,CAR-T细胞疗法治疗血液瘤30万/人计算,我们认为国内血液瘤市场空间有望达到58亿左右。假设:(1)淋巴瘤中DLBCL人数为90%NHL中的35%;白血病中ALL人数比例为20%-30%。(2)DLBCL中无法通过标准疗法治疗的比例大约为1/3,ALL中无法通过标准疗法治疗的比例大约为30%,死亡人数中基本为目前疗法失效、复发难治。(3)新发病人中,CAR-T细胞渗透率分别为10%、20%、30%;复发难治病人中渗透率分别为30%、40%、50%。(4)CAR-T国内价格为30万元/人份。
整顿后步入正轨、海外技术助力,看好国内CAR-T细胞行业发展
政策落地,助力中国CAR-T细胞疗法正式进入产业化阶段
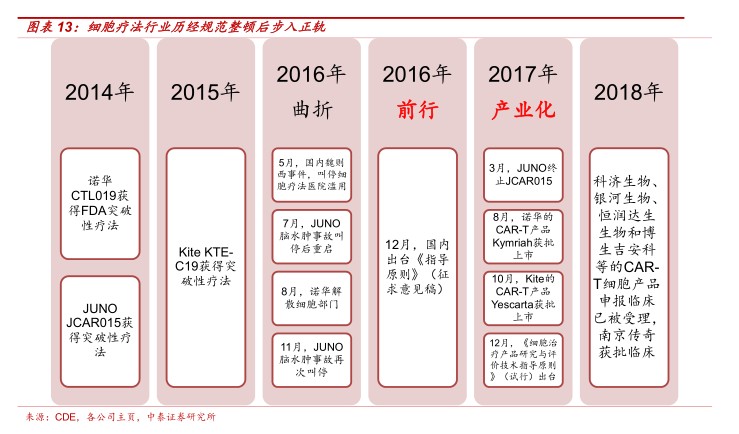
《细胞治疗产品研究与评价技术指导原则》正式落地,国内细胞治疗行业经历整顿和规范2017年重入正轨。2017年12月22日,CFDA出台《细胞治疗产品研究与评价技术指导原则》(试行)。《原则》第一次在国内权威定义按照药品管理规范研发的细胞治疗产品,对细胞产品的制备工艺提出高要求,对行业整体态度积极、推进CAR-T产品作为临床急需新药在我国尽早上市,包括“可接受非注册试验数据”、“临床试验分为早期临床试验和确证
性临床试验两部分即可”等鼓励性条款。我们认为,CAR-T细胞产品经历整顿和规范2017年重入正轨,《原则》导向疗效过硬、制备工艺准备充分的研发型企业。
引入海外成熟技术,多个CAR-T产品有望在2018年陆续进入临床阶段
海外成熟产品技术引入国内,力助力CAR-T细胞国产化。2016年起国内医药巨头陆续通过和海外成熟CAR-T产品公司合作,将CAR-T产品引入国内。2016年4月,药明康德宣布和JunoTherapeutics在上海成立合资公司药明巨诺,共同开展CAR-T和TCR疗法的研发和生产;2018年6月,上海药明巨诺及其关联公司上海明聚生物的CAR-T产品JWCAR029的IND申请获得CFDA批准。2017年1月,复星医药宣布通过旗下全资子公司成立中外合营企业,在中国引进KitePharma的CAR-T治疗产品KTE-C19等;2018年5月该产品已申报临床。2018年9月,诺华与西比曼生物科技集团(CBMG)宣布达成战略许可和合作协议,为中国患者生产制造CAR-T细胞治疗药物。至此,海外CAR-T细胞疗法最成熟、进度最快的三家企业产品即将全部进入中国。此外,安科生物和德国Miltenyi默天旎生物技术合作引入全自动化CAR-T细胞制备工厂。
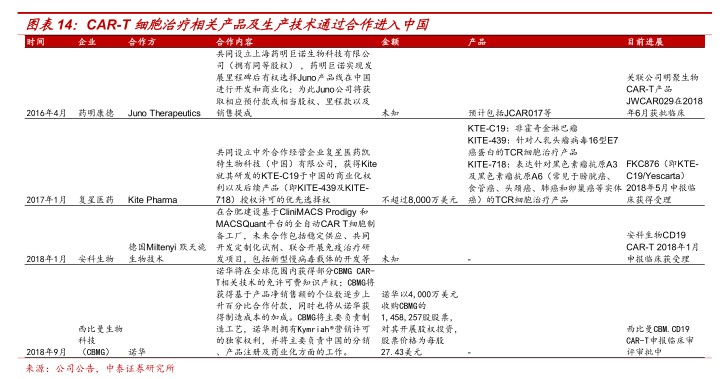
CAR-T细胞产品陆续获批临床,2018年揭开产业化元年。截止2018年8月底CDE已受理的CAR-T细胞产品临床申请共有24个产品,靶点以CD19为主,其他也包括BCMA。预计国内主要从技术较为成熟的CD19CAR-T治疗难治或复发急性淋巴细胞白血病(r/rALL)切入,与诺华的产品Kymriah相似。申报企业包括南京传奇、上海优卡迪生物、上海明聚生物、博生吉安科、科济生物、上海恒润达生生物、银河生物等多家企业。目前南京传奇、上海明聚生物等多家企业已陆续获批进入临床,我们认为2018年国内产业化陆续开启。
仍有问题需克服、任重道远,期待技术发展推动CAR-T细胞产品进一步成熟
虽然CAR-T细胞治疗已有产品成功上市,但仍存在诸多需要克服的难点。
1、CAR-T细胞疗法在血液瘤上展示了非同一般的效果,但目前面对实体瘤还需要克服实体瘤复杂肿瘤微环境、寻找更好的特异性肿瘤抗原、降低副作用等。值得欣喜的是,陆陆续续有许多科学突破在逐步发现,我们认为随着技术进步有望攻克更多实体肿瘤。
2、目前的技术工艺只能实现单人单次制备、无法规模化,造成CAR-T细胞价格较高、运输半径受限、固定资产投入大等问题。随着基因编辑技术的进展,未来通用型CAR-T产品或有望推出,大幅降低CAR-T产品的诊疗成本。
3、CAR-T细胞产品治疗血液癌的效果已毋庸置疑,但由于副作用问题,治疗前预处理较复杂、仍有部分患者出现死亡。因此,如何降低副作用、提高治疗的靶向精确性仍是临床应用需要解决的问题。
看好具备技术领先优势的企业,建议关注复星医药、药明康德、金斯瑞、安科生物等
CAR-T疗法领域技术是核心驱动力,重点关注具备技术领先优势(临床进展、适应症和靶点、产业化能力)的企业。CAR-T疗法作为一种新型的诊疗手段,归根到底针对是技术驱动企业发展。参考国外CAR-T疗法企业的发展路径,研发型企业(如JUNO、KITE)和大型药企(诺华、辉瑞等)最终都是以CAR-T疗法技术为核心竞争力,技术更好则可能获得更好的临床效果和更早获批上市,分享大市场。
复星医药:和Kite合作引入国际顶尖、已获FDA批准的CAR-T产品跻身细胞疗法第一梯队,制药、医疗服务和医疗器械的全产业链布局,生物类似药同样国内领先。复星医药全资子公司复星医药产业投资不超过8,000万美元(占50%)与Kite共同设立中外合作经营企业复星医药凯特生物科技(中国)有限公司,开拓中国癌症T细胞免疫疗法市场。未来综合不同肿瘤免疫疗法的优势使用鸡尾酒疗法已成为行业共识,细胞疗法+免疫抑制剂PD-1+单抗联用是趋势,公司生物类似物研发也走在国内第一梯队,未来在单抗和细胞疗法领域有望引领国内趋势。
药明康德:CRO全产业链龙头、技术累积深厚,药明诺巨诺CAR-T产品已获批进入临床。公司是全球公认的具备新药研发实力的领先开放式、全方位、一体化的医药研发服务能力与技术平台,提供包括临床前CRO、临床CRO和CMO等多项业务。公司与全球进度领先的细胞免疫治疗公司JunoTherapeutics在联合共同组建药明巨诺引入海外处于临床Ⅱ期的JCAR017等CAR-T细胞产品。目前第一个产品JWCAR029(CD19靶向嵌合抗原受体T细胞)已获批进入临床。
金斯瑞生物科技:主业稳定,CAR-T细胞治疗产品国内首个获批进入临床。公司与Janssen合作在中美两国推进其CAR-T产品LCAR-B38M的临床试验。国内临床申报于2017年12月受理并进入拟优先审评名单,2018年3月临床获批,8月13日已公示开始招募患者。美国方面,合作伙伴Janssen于2018年5月获批开展Ⅰb/Ⅱ期临床试验。
安科生物:内生增长稳健的精准医疗标的。(1)主营业务后续增长动力强劲。安科生物核心产品生长激素粉针保持40%以上增速,2018年生长激素水针剂有望上市进一步加速业绩增长;此外更有长效生长激素、HER2单抗等大品种处于临床Ⅲ期。(2)优质子公司中德美联在法医检测领域保持领先优势,Y染色体库和常染色体库建设稳步推进;苏豪逸明深耕多肽原料药领域,缩宫素原料药待审评。(3)精准医疗全产业战略先行者:公司在检测、精准诊断和精准治疗等领域已完成前期布局,策略走在行业最前沿,5年后精准医疗有望逐步进入收获期。子公司博生吉安科靶向CD19自体嵌合抗原受体T细胞输注剂已申报临床获得受理。
风险提示
CAR-T疗法临床效果不及预期风险
国内CAR-T技术多数均只在科研临床上验证过,仍没有产品进入临床后期阶段。一旦正式临床试验效果不理想,将会大大影响对于国内CAR-T疗法产业化的预期。
国内CAR-T审批和管理的政策风险
细胞免疫疗法作为活细胞生物制品,其本身的临床研究要求高、管理难度较大。目前国内《细胞治疗产品研究与评价技术指导原则》落地不足一年,仍存在许多挑战。
企业研发进展不及预期风险
目前国内所有涉及CAR-T疗法的企业均处于研发阶段,未来企业的研发进度和产品疗效直接影响到企业该业务领域的发展,存在进展不及预期的风险。(编辑:刘瑞)




 扫码下载智通APP
扫码下载智通APP