国产生物药出海 复宏汉霖(02696)PD1领航
复宏汉霖(02696)开簿招股,无疑是近日港股市场最引人瞩目的大事。身为国产生物药研发的领头羊,复宏汉霖担负着业界和资本市场的双重期待,公司在研发、生产和商业化等方面的国际化步伐,也是有条不紊的向前迈着。
就在9月12日,复宏汉霖宣布与印度尼西亚制药公司PT Kalbe Farma, Tbk旗下控股子公司PT Kalbe Genexine Biologics(以下简称“KG Bio”)达成合作共识,授予KG Bio就复宏汉霖自主研发产品HLX10(重组抗PD-1人源化单克隆抗体注射液)的首个单药疗法及两项联合疗法在东南亚地区10个国家的独家开发和商业化权利,预计总计金额可达6.92亿美元。
在这转瞬即逝的发展窗口期,复宏汉霖不仅率先打破了国产单抗生物类似药零的突破,正式拉开中国本土研发的生物类似药造福患者的帷幕。还秉持“以优质生物药,造福全球病患”的使命,积极开展全球商业化布局,领航国产生物药“出海”之路。
与KG Bio的合作,无疑是复宏汉霖国际化的一个剪影。
创新高效的国际化研发能力
创新型生物医药公司发展的背后,技术与专利的竞争从未间断。目前全球各大生物医药企业都在加大研发投资,争夺技术成型后的市场份额。在此行业大背景下,为实现“可负担的创新”愿景,复宏汉霖也在积极推进国际化研发进程,加快开展海外临床研究的战略步伐。
生物医药研究追求“创新高效”,研发过程不仅确保创新性、高产出,同时还需兼顾成本效益。为此,在研究方面,复宏汉霖建立了高效的一体化全球研发平台,公司分别在中国的台北和上海及美国的加州建立了三大研发中心。
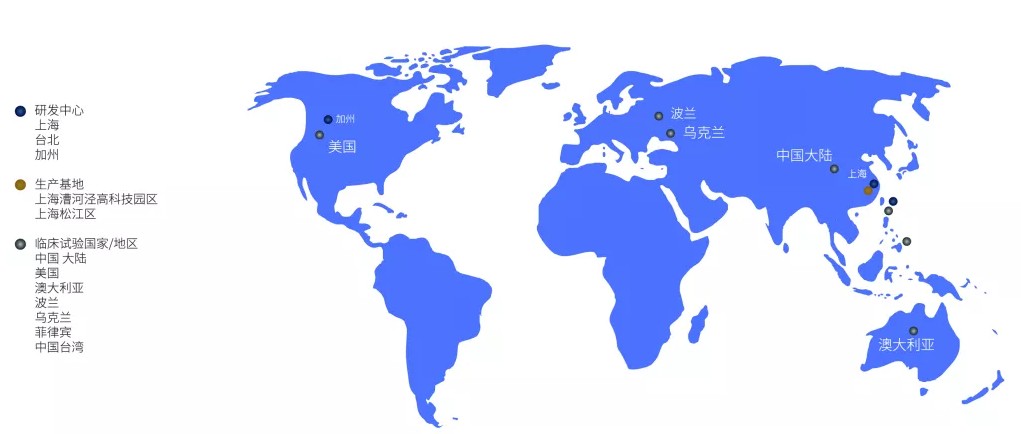
据智通财经APP了解,复宏汉霖在台北和加州研发中心主要负责早期研发,帮助公司快速了解和把握单抗领域的最新发展及尖端技术,而上海研发中心则主要负责研发后期阶段,例如产程及制剂开发。
以复宏汉霖位于中国台北的研发中心为例,目前该研发中心已建立起50余种动物药效模型和基于X射线衍射晶体的蛋白质3D 结构解析技术平台,帮助分析生物大分子蛋白质的功能,以开发更加有效的疾病治疗药物。
公司高度重视国际化生物医药人才的引进,截至今年3月,复宏汉霖已组成了一支囊括239名资深研发雇员的团队,其中大部分在免疫学、生物化工、制药工程等领域拥有博士或同等学位,并且众多研发人员还拥有全球大型制药公司的丰富工作经验,致力于参照国际标准开发生物药。
除建立研发中心,在海外开展临床研究同样也是一家生物医药企业走向国际市场的关键所在。
对于复宏汉霖而言,凭借多年的积累,目前在海外的药政注册能力、临床开发和运营能力可支持公司在全球多个地区开展临床试验。
公司目前已在7个不同司法权区(中国大陆、中国台湾、菲律宾、乌克兰、波兰、美国及澳大利亚)同时进行11项临床试验,涉及处于多个临床试验阶段的8种候选产品及2个肿瘤免疫联合疗法。
复宏汉霖核心产品之一的HLX02(注射用曲妥珠单抗)已完成在中国大陆、乌克兰、欧盟波兰和菲律宾开展的国际多中心3期临床试验,成为国内首个开展国际多中心3期临床研究的生物类似药,现已获得中国国家药监局(NMPA)和欧盟药品管理局(EMA)新药上市申请受理。
而公司的重磅免疫治疗创新药HLX10(抗PD-1单抗注射液)则是产品国际化布局的另一重要实践。公司招股书披露,HLX10申请了中国台湾和PCT专利授权,目前在多个国家和地区推进临床研究。除中国大陆外,亦在中国台湾、美国获得临床试验许可。与此同时,公司已陆续就HLX10与自有产品HLX04(贝伐珠单抗注射液)、HLX07(抗EGFR单抗注射液)等单抗以及化疗联用开展多项肿瘤免疫联合疗法,在全球范围内开展多个临床研究。
其实,寻求国际科研人才、开展海外研发和临床试验,仅仅是复宏汉霖国际化布局的重要一环。在复宏汉霖的国际化布局中,建立全面质量管理体系、大力发展海外商业化能力同样不可或缺。
海外商业化提速在即
复宏汉霖践行国际化战略布局,其核心在于“布局全球,秉质前行”,以中国为起点,面向全球受众。
一直以来,复宏汉霖都是依托质高价优的产品进入国际舞台。在公司看来,全面完善的质量管理体系是公司“走出去”的前提。
智通财经APP了解到,复宏汉霖已建立起一套全面质量管理体系,符合美国、欧盟及中国的质量标准,为公司产品在多个司法权区及地区的商业化奠定基础。公司徐汇生产基地现已通过欧盟质量受权人(QP)检查,并具备了GMP认证的生产能力。其中,公司首个产品汉利康已正式获得《药品GMP证书》。
复宏汉霖的质量管理体系覆盖了从产品研发到物料管理、产品生产、质量控制、产品供应链管理及产品上市后监督的整个产品周期。在具备大量海外药品质量管理实践经验的专家团队的管理下,复宏汉霖的徐汇基地及配套的质量管理体系已顺利通过多项由欧盟质量受权人以及我们的国际商业合作伙伴(如Accord 及Cipla)进行的实地核查及/或审计,每次核查均严格遵循标准。
以欧洲为例,在欧盟药品法规框架下,生物类似药只允许采用集中审批程序(Centralized Procedure)。据了解,CP的审批周期是210天,但如果在120天EMA发出缺陷信,“clock”就会暂停,待收到缺陷信回复后,重新开始计时。因此这就对申报药物的质量提出了很高要求。自2006年开始,该机构下属的CHMP也仅批准了28种生物类似药。
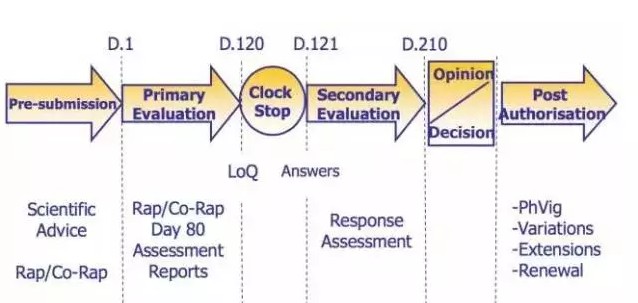
(生物类似药在欧盟的审评流程)
而在今年,复宏汉霖的曲妥珠单抗药物HLX02正式获得EMA受理,成为首个被欧盟受理的“中国籍”曲妥珠单抗。这足以从侧面反映出复宏汉霖质量管理体系的高效与严谨。
依托高质量的产品管线,复宏汉霖的海外业务得以加速开拓。除体系先进、完善的欧美市场外,考虑到许多国家和地区在生物药的可及性和负担能力上的高度局限性,复宏汉霖也将商务合作的重点放在众多用药需求未被满足的新兴国家市场。
与KG Bio合作后,双方将在菲律宾、印度尼西亚、马来西亚、新加坡、泰国、老挝、缅甸、柬埔寨、文莱和越南等国展开深层次合作。借助分销渠道,复宏汉霖将加快HLX10产品在东南亚地区市场拓展的步伐,进而持续增强其在东南亚乃至全球肿瘤免疫治疗市场上的话语权和竞争力。
这仅仅是复宏汉霖海外商业化布局的一部分。
早在2017年12月,复宏汉霖便与雅各臣药业达成合作协议,授权其在中国香港、中国澳门就HLX02开展独家开发和商业化行为,并因此获得在部分东盟国家的优先谈判权。
2018年6月下旬,复宏汉霖与英国Accord公司签订合作协议,授权其在欧洲地区包括英国、法国、德国和意大利等在内的53个国家,中东及北非地区17个国家和部分独联体国家对HLX02产品进行独家商业化开发。该协议可以让复宏汉霖借助Accord渠道快速进入欧洲市场。
此外,复宏汉霖还与阿根廷生物医药先锋企业Biosidus、世界顶级制药企业Cipla等合作伙伴签订了授权及商业化供应协议:复宏汉霖与Biosidus就HLX01(利妥昔单抗注射液)达成协议,独家授权了其在拉丁美洲的部分新兴国家市场的开发和商业化;此外,复宏汉霖独家授权Cipla对HLX02在亚太和拉丁美洲地区部分新兴国家市场的开发和商业化。
可以预见,通过借助KG Bio、Accord、Biosidus、Cipla和雅各臣药业等国际知名药企的分销渠道,复宏汉霖的产品将销往更多新兴国家市场,惠及更多病患。而在今后复宏汉霖也将充分发挥公司“整合创新、协同增效”的优势,继续推动国际化战略的落地。



 扫码下载智通APP
扫码下载智通APP