默沙东(MRK.US):全球首款“埃博拉终结者”疫苗获批上市
本文源自“新康界”微信公众号。
12月23日,美国FDA正式宣布:批准默沙东(MRK.US)用于预防埃博拉病毒的疫苗Ervebo上市!Ervebo用于对18岁或18岁以上的个人进行主动免疫,以预防埃博拉病毒引起的埃博拉病毒病(EVD)。这是FDA批准的首个预防埃博拉病毒的疫苗,也是全球首款预防埃博拉疫苗!

世界公共卫生隐形杀手
埃博拉病毒病是由埃博拉病毒引起的,通过接触病人的血液或其他体液,经皮肤、呼吸道或结膜感染的急性出血性传染病,潜伏期2至21天,病死率50%至90%,起病急、症状重,高热并伴有乏力、头痛、呕吐、腹泻、皮疹等,病程第3至4天后感染中毒症状及消化道症状加重,有不同程度的出血,严重者可出现意识障碍、休克及多脏器衰竭。埃博拉病毒病是目前危害世界公共卫生安全的一大传染病。
图表 1 埃博拉病毒显微镜结构
资料来源:百度百科,中康产业资本研究中心
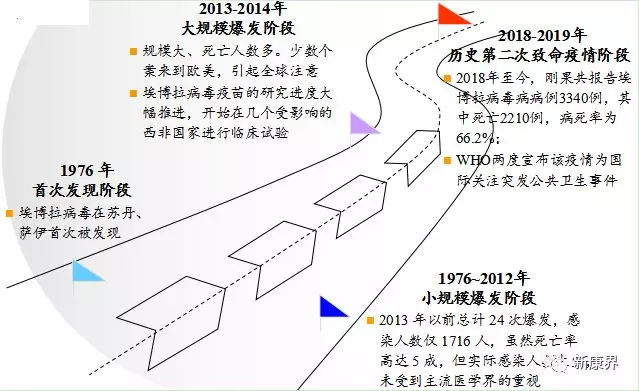
埃博拉病毒在1976年就被首次发现,如今时隔近半个世纪才研发出有效的应对方案,主要是由于埃博拉病毒的流行演变特征。
埃博拉病毒于1976年在苏丹、萨伊被首次发现,但在2013年以前都只是小规模爆发。据统计,2013年以前,埃博拉总计爆发24次,感染人数仅1716人。虽然死亡率高,但由于实际感染人数太少,并未受到主流医学界的重视。
直至2013年-2014年,埃博拉病毒大爆发。根据世界卫生组织(WHO),此次埃博拉疫情感染人数超过1.6万例,死亡人数近6000例,绝大多数感染和死亡病例发生在几内亚、塞拉利昂和利比里亚,还有少数个案来到欧美,这才引起了全球药企的注意。埃博拉病毒专家表示,如果没有疫苗,埃博拉疫情不大可能得到控制。此后,埃博拉病毒疫苗的研究进度大幅推进。
2018年8月以来,刚果爆发历史上第二次致命的埃博拉疫情。根据WHO 2019年12月12日通报,2018年8月1日至2019年12月10日,刚果第10轮埃博拉病毒病疫情共报告埃博拉病毒病病例3340例,其中死亡2210例,病死率为66.2%。2019年7月17日,WHO召开紧急委员会会议,宣布刚果的埃博拉病毒病疫情为国际关注突发公共卫生事件。直到2019年10月18日,WHO仍然宣布维持该疫情为国际关注突发公共卫生事件。
图表 2 埃博拉疾病发展史
资料来源:中康产业资本研究中心
昨日(12月23日),我国海关总署发布《关于防止刚果民主共和国埃博拉病毒病疫情传入我国的公告》,对来自刚果的人员、交通工具、集装箱、货物(含尸体骸骨)、行李物品、邮件、快件等人员或物品的入境作出规定,以防止刚果埃博拉病毒病疫情传入我国。
图表 3 我国海关总署发布防止疫情公告
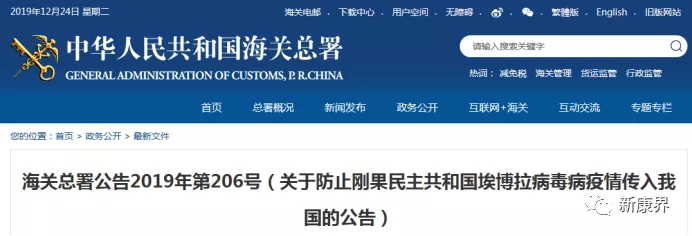
资料来源:海关总署官网,中康产业资本研究中心
魔高一尺道高一丈,疫苗研发正当时
哪里有“侵略”,哪里就有“反抗”。自从2013年埃博拉大爆发后,几家国际药企都开始着手埃博拉疫苗的研发。
进度最快的是默沙东的Ervebo,这是一种利用埃博拉病毒经过基因改造的单剂量注射减毒活疫苗。由于Ervebo保护力几乎百分之百,且疫苗的副作用又相当轻微,因此FDA授予了Ervebo突破性药物资格。又由于预防埃博拉病毒病对公众健康的重要性,FDA在不到6个月的时间内完成了对Ervebo安全性和有效性的评估,较处方药用户收费法(PDUFA)目标日期2020年3月14日提前了近4个月。而在11月11日,Ervebo疫苗刚被欧盟委员会批准有条件上市,预计2020年生产上市。
强生的埃博拉疫苗也于2015年进入临床试验。11月初,强生的埃博拉预防性疫苗方案在欧盟进入加速评估阶段。该疫苗方案分为两针:(1)第一针是Ad26.ZEBOV,该疫苗基于杨森的AdVac技术开发;(2)大约8周后,注射第二针MVA-BN-Filo,该疫苗基于Bavarian Nordic公司的MVA-BN技术。目前,强生正在与FDA讨论监管所需数据,并与WHO合作在非洲国家注册上述疫苗方案。
葛兰素史克(GSK)研发的实验性双价埃博拉疫苗也在2015年宣布顺利通过II期临床安全性试验。该疫苗利用黑猩猩腺病毒3型(ChAd3)感冒病毒作为载体,将2株埃博拉病毒(苏丹株和扎伊尔株)的遗传物质递送至体内。该公司开发的另一种针对扎伊尔株(Zaire strain)的单价埃博拉疫苗也正在研究阶段。(编辑:任白鸽)



 扫码下载智通APP
扫码下载智通APP