2019年,我心目中的那些新药研发重大突破
本文来源微信公众号“医药魔方”。
到年底了,总结一下我心目中2019年的那些新药研发重大突破。当然,这只代表我的个人观点,总结得也也可能不太全面,供大家参考。
1. 埃博拉病毒疫苗及药物
埃博拉病毒感染后造成埃博拉出血热非常惨烈,身体内组织被液化,导致大面积出血,患者会吐血、七窍流血、毛孔出血......然后死亡。该病传染性强,发病快,死亡率高,经常造成整个村子人口灭绝。
2019年,默沙东的扎伊尔型埃博拉病毒疫苗获得欧洲及美国批准上市,该疫苗保护效应强,在刚果(金)已有超过20万人接种。但该疫苗仅针对扎伊尔型埃博拉病毒,还有苏丹型埃博拉病毒曾造成大量死亡。因此,目前仍有数个其他疫苗在研发中,以期实现完全预防埃博拉病毒的目标。
中国曾于2017年批准国内某研究所及企业研发的埃博拉病毒疫苗,但并未在非洲有大面积接种案例。
除疫苗外,再生元的三种单抗混合的REGN-EB3和Ridgeback的单抗mAb114也证明了可以大幅降低埃博拉病毒感染后的死亡率,成为治疗这一疾病的重大突破。
埃博拉病毒疫苗及药物的研发体现出这一行业中的好的一面:由于这一疾病仅存在于全球最欠发展的国家,研发药品无利可图,也无关发达国家的公共卫生。但发达国家公共卫生部门的研究机构和制药企业联手,解决了这一危险的疾病,为这些最欠发展的国家解除了重大风险。
2. 诺华(NVS.US)治愈脊髓性肌肉萎缩症(SMA)基因疗法Zolgensma
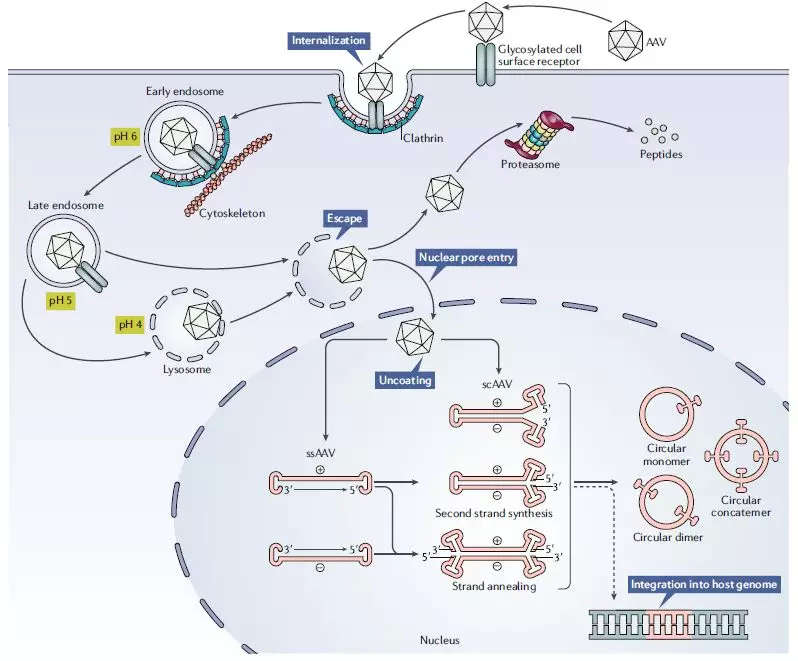
AAV疗法的原理(来源:Adeno-associated virus vector as a platform for gene therapy delivery, Nature Reviews Drug Discovery)
治愈(注意是“治愈”)一项疾病总是令人兴奋,尤其是这一疾病是基因缺陷导致的疾病,且患者通常会在2岁内死亡。
该疗法的成功也证明了腺相关病毒载体(AAV)的成功,即可将正常的基因递送入人体细胞内,以治愈基因缺陷导致的疾病。这项技术的前景并不仅限于治愈脊髓性肌肉萎缩症(SMA)。
不过,诺华给这一疗法的定价高达1500万人民币——这带来了一个问题:到底应该为一个人正常地度过一生(而不是2岁前死掉)支付多少钱?这不仅是一个经济问题,也是个伦理问题。
3. 安进(AMGN.US)的KRAS G12C抑制剂AMG 510
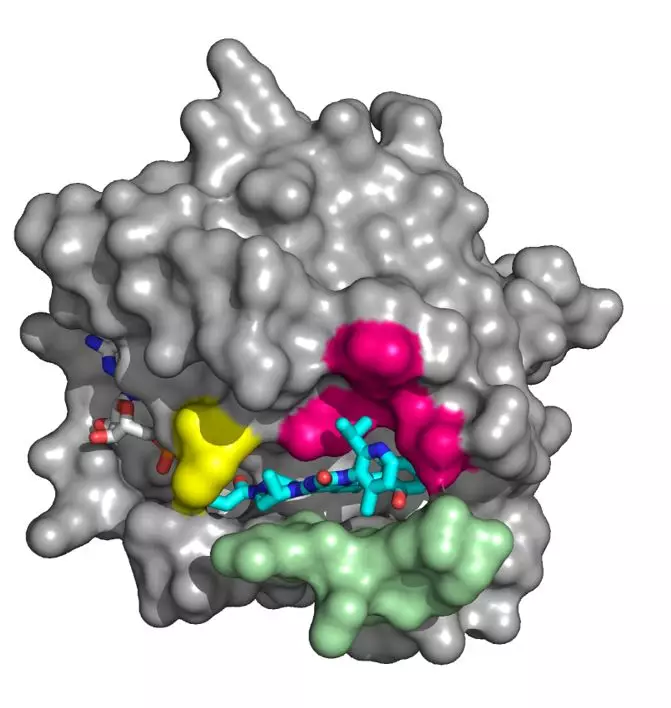
AMG 510与KRAS G12C的结合(来源:Amgen unveils its KRas inhibitor in human clinical trials, C&EN)
上世纪80年代初,RAS基因就被确认为首个人类癌症的元凶,但RAS靶向抑制剂却迟迟没有上市,其原因是由于RAS蛋白结构平滑,其表面缺乏可以结合小分子的疏水性口袋,因此被长期认为是“不可成药”。AMG510是通过结合KRAS蛋白表面隐藏的沟槽来发挥作用,可以与突变的KRAS蛋白上的半胱氨酸发生不可逆结合,从而使KRAS进入失活状态。
这一突破为RAS抑制剂的研发打开了大门,KRASG12D抑制剂已近在眼前。不过,AMG 510可能存在耐药较快发生的问题,亟需解决。
这一突破也说明新药研发的艰难之处——从原理被确认到新药被研发,耗时近40年。
4. 第一三共DS-8201末线治疗HER2阳性乳腺癌
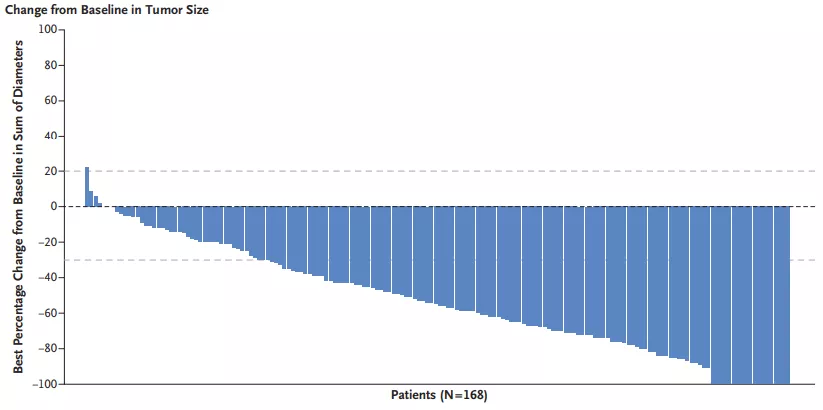
DS-8201的瀑布图(来源:Trastuzumab Deruxtecan in Previously Treated HER2-Positive Breast Cancer, The New England Journal of Medicine)
2019年12月,FDA以惊人的效率:仅仅两个月就审批通过的第一三共的HER2抗体偶联药物DS-8201的上市申请,其原因自然是该药极其优异的疗效。
在平均接受过6种治疗但失败的HER2阳性乳腺癌患者中(100%的患者使用过曲妥珠单抗,100%的患者使用过T-DM1,65.8%的患者使用过帕妥珠单抗,54.3%的患者使用过其他anti-HER2疗法,48.9%的患者使用过激素疗法,99.5%的患者使用过其他系统疗法。换言而之,这些患者几乎已经无药可治了),客观缓解率ORR达61%,其中11位患者为完全应答;中值应答时间为14.8个月,PFS为16.4个月。甚至,HER2低表达患者也可受益。
DS-8201突破性的毒素选择、连接物设计、“载弹量”(Drug-to-Antibody Ratio),并利用了“旁观者效应”,这可能是其效果如此惊艳的原因。不过,该药造成间质性肺炎的风险高,值得临床医生密切关注。
另外,DS-8201是在末线治疗中取得如此惊艳的效果,而其他某些ADC在二线治疗的临床试验中取得的数据与DS-8201并不具备可比性,这一点必须分辨。值得注意的是,FDA在2019年批准了3个ADC药物,ADC是否将迎来又一春?
5. 罗氏的PD-L1 Tecentriq联用贝伐珠单抗治疗不可切除的肝癌
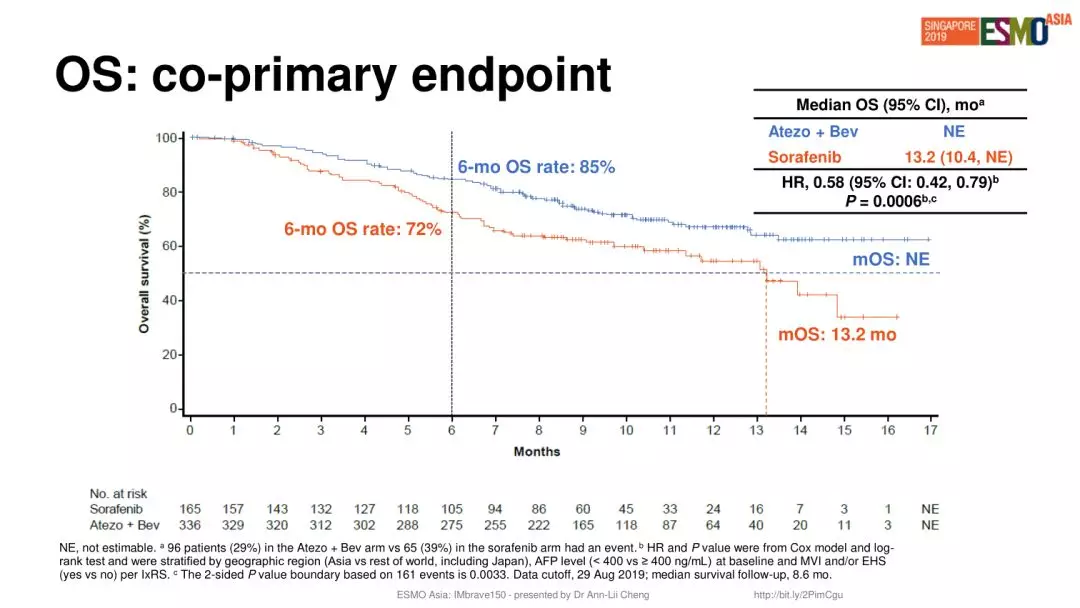
Tecentriq + Avastin vs 索拉非尼治疗不可切除的肝细胞癌的生存曲线(来源:罗氏于ESMO-Asia 2019会议中的展示) 肝癌是国内最大的癌症种类之一,每年有40至50万人罹患肝癌,而且普遍发现较晚,发现时即无法手术切除的比例高。乙肝、饮酒和不健康饮食是导致我国肝癌发病率高于世界平均水平的重要原因。
2007年上市的索拉非尼是治疗不可切除的肝细胞癌的经典一线药物,十多年之后的2018年方有仑伐替尼的同一适应症上市,但在主要研究终点的总生存期上,仑伐替尼仅“非劣效于”索拉非尼。
在Tecentriq + Avastin vs 索拉非尼治疗未接受系统治疗的不可切除肝细胞癌患者的Ⅲ期IMbrave 150研究,总生存期预计将有显著优势(尚未达到 vs 13.2 个月),死亡风险降低42%(HR=0.58; 95% CI: 0.42~0.79; P=0.0006)。
国内亦有跟进者。目前,信达生物和复宏汉霖的PD-1联用贝伐珠单抗治疗不可切除的肝细胞癌的Ⅲ期临床试验正在展开,处于招募患者阶段。我们期待看到良好的结果。
6. 阿斯利康(AZN.US)公布奥希替尼的FLAURA研究的最终结果
奥希替尼 Vs 对照组EGFRTKI的生存曲线(来源:阿斯利康于ESMO2019会议的展示) 非小细胞肺癌是最大的癌症种类,国内每年罹患非小细胞肺癌的患者超过70万人,其中超过一半是EGFR阳性。奥希替尼成为EGFR阳性的非小细胞肺癌的一线疗法已经不算新闻了,阿斯利康公布FLAURA试验的总生存期的结果则用数字证明了这一点。
奥希替尼治疗组的中位OS为38.6个月(95%CI: 34.5~41.8),对照组(一线使用吉非替尼或厄洛替尼)为31.8个月(95% CI: 26.6~36.0),具有显著性差异(HR=0.799; 95% CI: 0.641-0.997; P=0.0462)。
尤其值得注意的是,对照组交叉到奥希替尼治疗组的人数占到对照组所有发生进展人数的47%,占对照组全部有效入组人数的31%。这代表了真实世界中“一代序贯三代”可以取得的成果。本试验中交叉的比例相当高,而在真实世界中,一代治疗失败后可换用三代的比例很难达到本试验中的比例。换句话说,真实世界中,“一代序贯三代”的数据估计更弱于本试验中的对照组。因此,也无需过于关注亚裔亚组的结果,不仅因为亚组分析本身的可靠性通常较有限,也因为交叉比例与真实世界中可能存在明显差异。
在奥希替尼的良好结果之后,这一领域未来的研究将更加集中于患者后线治疗方案。
7. RNAi即将进入“大”世界

哺乳动物miRNA生物发生、合成RNAi触发过程以及RNAi沉默的通路(来源:The current state and future directions of RNAi-based therapeutics, Nature Reviews Drug Discovery)
2018年和2019年已分别有两款RNAi新药Onpattro (patisiran)和Givlaari(givosiran)获批上市,分别治疗遗传性ATTR(hATTR)淀粉样变性成人患者第1阶段或第2阶段多发性神经病、成人急性肝卟啉症(acute hepatic porpyria, AHP)。虽然这两个适应症较小,但也验证了RNAi这一技术的成功性。
2019年11月,诺华以约97亿美元的价格收购美国药企The Medicines Company则震撼了市场,收购的目的显然是为了取得其可能的重磅产品Inclisiran,一种长效PCSK9抑制剂。PCKS9抑制剂已经不是新闻,两种单抗:安进的Repatha(evolocumab)和赛诺菲的Praluent(alirocumab)已经上市。相对于这两种单抗的每两周或每月皮下注射,Inclisiran仅需每年皮下注射两次,更加方便。不仅如此,Inclisiran可以通过化学方式合成,生产过程更加简洁。如果Inclisiran能成功上市,那这意味着RNAi技术在大病种上获得了验证,并有望继续扩张新的领域。
8. 双抗呈现曙光
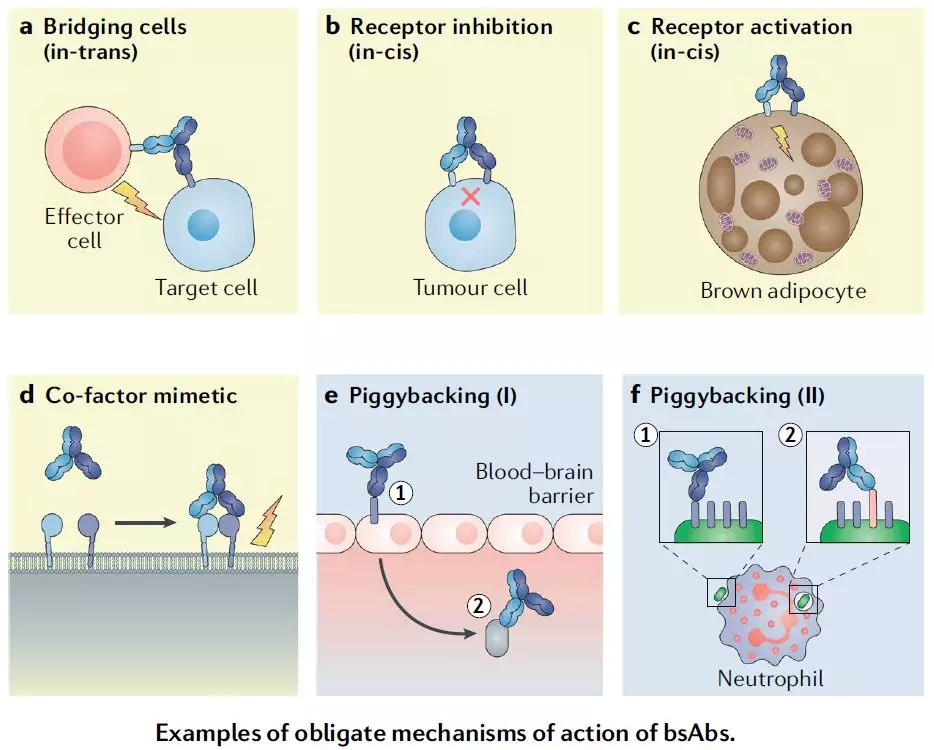
双抗作用原理的案例(来源:Bispecific antibodies: a mechanistic review of the pipeline, Nature Reviews Drug Discovery)
再生元和罗氏的CD3 x CD20双抗REGN1979与RG7828均披露了早期临床数据,在弥漫性大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤(FL)等一系列适应症上均取到了良好的数据,包括高比例的完全应答。在招募的患者中,甚至包括CAR-T治疗后失败的患者,而在这些患者中,CD3x CD20双抗也取得了一定比例的应答甚至完全应答。
目前全球已获批的双抗共有3个,其中首个CD3 x EpCAM双抗Catumaxomab因销售不佳,已经退市;Blinatumomab(靶向CD3和CD19)和Emicizumab(靶向凝血因子X和因子IXa)仍在销售。
CD3 x CD20与CD3 x CD19均为上图中a类型的双抗。我们也期待看到其他类型双抗的研究取得进展,并造福患者。
9. 达格列净可显著降低心血管死亡和心力衰竭恶化风险
达格列净 Vs 安慰剂的主要结果(来源:Dapagliflozinin Patients with Heart Failure and Reduced Ejection Fraction, The New England Journal of Medicine) 达格列净本是SGLT2抑制剂,是糖尿病领域的常见药物。阿斯利康在代号为DAPA-HF的临床试验中,通过招募多达4744位左心室射血不足心衰(HFrEF)患者,证明了达格列净可显著降低心血管死亡和心力衰竭恶化的风险,无论这些患者是否伴有糖尿病。
除达格列净外,另一种SGLT2抑制剂恩格列净也有类似临床试验正在进行中。
心衰是一个机理复杂的常见大众病,全球约有患者6400万人,但可用于治疗该疾病的药物不多,近20年来也仅有诺华的Entresto(沙库巴曲缬沙坦钠)在2015年获批上市,该药本质上是个降压药。SGLT2抑制剂被证明对心衰患者有效,这为心衰患者提供了一个新的选择。
10. 抗CD47单抗Magrolimab早期临床数据初现曙光
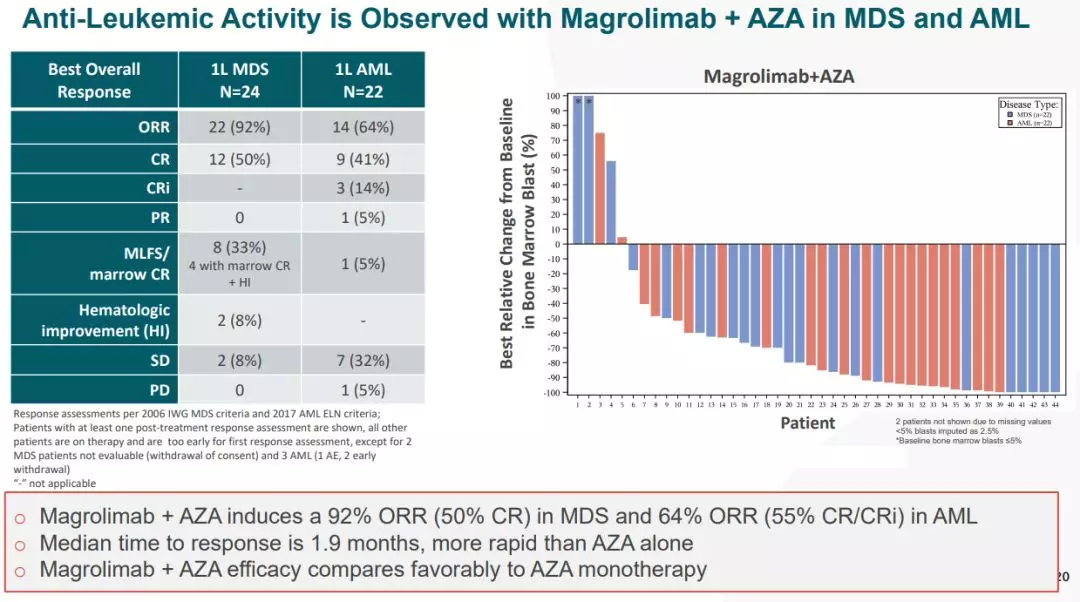
Magrolimab联用阿扎胞苷治疗高危MDS(骨髓增生异常综合症)和初治AML(急性髓细胞白血病)的早期临床数据(来源:Forty Seven公司于ASH2019会议上的展示) 异常细胞通过表达“别吃我”的信号CD47,逃过免疫系统的攻击。抗CD47单抗则可阻断“别吃我”的信号,从而带来抗肿瘤的效果。不过,由于CD47广泛分布于人体各种细胞中,特别在红细胞及血小板中具有较高的表达水平,使得靶向CD47的抗体药物会引发严重的溶血性贫血。Forty Seven公司尝试出一条新路径,即先用较低剂量的抗CD47单抗令患者适应,随后增大剂量达到了CD47受体的完全饱和(约100%),从而解决了此问题。在本次披露的数据中,仅有1名患者(1/62=1.6%)因副作用而停药。
国内药企中跟进CD47靶点的企业已有不少,包括信达生物(01801)、天境生物、恒瑞医药等。信达生物还设计了PD-L1/CD47双抗IBI-322,申报临床已获受理,我们期待看到这一有趣品种的研发进展。(编辑:刘瑞)



 扫码下载智通APP
扫码下载智通APP