从核心产品获FDA“孤儿药”、快速通道资格 看亚盛医药(06855)市场价值
在生物医药行业,通过申请孤儿药资格认定和获取快速审评通道,已成为各大药企实现新药快速上市的两大重要策略。对于亚盛医药-B(06855)而言,短短几日内,核心产品HQP1351相继获得FDA孤儿药资格认定和快速通道资格(FTD),意味着公司已踏出通往国际商业化道路的关键一步。
智通财经APP了解到,30个交易日涨幅已超过50%的亚盛医药,在5月4日、7日接连发布公告,称公司核心候选产品HQP1351相继获得美国FDA授予的孤儿药认证和快速通道资格,对应适用症均针对慢性髓性白血病CML。


凭借拥有在立项、研发、审批等多个过程中享受税收减免、特殊通道、加速审批等优惠,近年来罕见病治疗市场的热度正在持续提升。而在拥有一张“孤儿药认证”门票后又顺利获得FTD资格,无疑代表着HQP1351在美研发、审评及上市阶段将享有更大的便利,加速公司海外市场的发展,对于公司进一步释放内在价值具有重要意义。
“孤儿药认证+FTD”加速HQP1351落地
在对亚盛医药2019年财报进行解读时,智通财经APP曾提到“核心候选产品HQP1351商业化在即”是该财报披露的最直观的信息。时隔一个月,在获得FDA孤儿药认证以及FTD资格后,HQP1351的落地将得到进一步地加速。
智通财经APP一直强调,亚盛医药具备拥有较高的成长确定性和中长期投资价值,原因在于其拥有强劲的投入实力和全面推进的管线落地进度。
凭借在药物结构设计及创新药物研发领域的实力,亚盛医药已构建包括8项处于临床阶段的小分子候选药物在内的丰富产品管线。截至2019年12月31日,公司在全球范围内共有21个临床批件,在美国、澳洲及中国正进行30多项I或II期临床试验。而在公司丰富的产品管线中,研发进展最快的便是公司的核心候选产品HQP1351。
HQP1351作为一款针对格列卫耐药研发的第三代Bcr-Abl/KIT抑制剂,能够靶向不同种类的Bcr-Abl突变体,可以有效克服一代、二代BCR-ABL抑制剂的耐药缺陷。初步数据显示,HQP1351耐受性好,疗效显著,特别是对T315I突变的CML患者具有突出的疗效。
在国内,HQP1351现已获得“一次性伞式批准”。公司正研发HQP1351作为单一疗法治疗TKI耐药性或伴有T315I突变的慢性髓性白血病CML患者和TKI耐药复发/难治性胃肠道间质瘤GIST患者;两项伴有T315I突变的慢性髓性白血病慢性期和加速期关键II期临床试验也正在进行中,现已完成该等两项研究的患者招募。公司计划于2020年在中国递交新药上市申请(NDA)。根据当前的研发进度和研发成果,HQP1351在国内获批的可能性十分高,短期内有望快速实现商业化。
在海外研发方面,去年7月,FDA审批通过了公司在美国开展治疗伴有T315I突变或TKI耐药慢性髓性白血病患者的Ib期临床试验申请,首名患者于今年1月开始用药。如果按照常规流程,HQP1351在美国的申报还需经过多期临床试验,但在获得FDA孤儿药认证和FTD资格后,HQP1351在美落地进程将得到极大提速。
据智通财经APP了解,“孤儿药”即治疗罕见病的药物。美国于1983年通过《孤儿药法案》,并在2013年发布了最新的修订版本,对于在美国患者少于20万人的罕见疾病,授予治疗用药特别的优惠权利。
根据法案,在美孤儿药研发将享有多项优惠,包括在美国开展临床试验税收减半;新药申请费免除,享有7年的市场独占权且不受专利影响,期间FDA不会再批准其他厂家申报同类产品;更高的自由定价权等。在这些优惠中,最重要的莫过于享有7年市场独占权。也就是这一优惠为新药上市后顺利进行市场扩张铺平道路,其余企业就算想仿制也需要7之年以后,最大程度保障了相关企业的市场经济效益。
实际上,在全球医药行业,申请孤儿药资格一直是极具性价比的商业策略。但想要通过孤儿药认证并不容易。统计数据显示,从孤儿药法案推出的1983年到2017年,获得孤儿药“指定”(Designation)的药物仅有14.6%得到了最终许可;2010-2017年,获得孤儿药上市许可的药物从进入“候选”名单到获得“许可”的平均用时为5.3年之长。
对于初次申请的企业来说,申报孤儿药的资质主要是围绕两个方面:一方面,申报的适应症要符合当地药监局法规的流行病、申报适应症的严重性和危害性要求;另一方面,申报的药品要有明确的科学原理、要有足够的非临床/临床支持性数据,与当地现有的上市药品相比具有比较优势。
对于HQP1351来说,与目前上市的首款第三代BCR-ABL抑制剂ponatinib(帕纳替尼)相比,HQP1351对细胞集落形成、细胞迁移和侵袭,细胞周期停滞和细胞凋亡的抑制作用更强,在源自伊马替尼耐药的GIST细胞系的异种移植肿瘤模型中,HQP1351还表现出优于ponatinib的抗肿瘤活性。
在授予HQP1351孤儿药认证后,FDA还为其开通了一条快速审评通道(FTD)。同时拿到FDA双认证资格,在中国生物医药史上还是比较少见的。
智通财经APP了解到,开通FTD对于新药研发和上市而言至关重要。实验性药物获得快速通道资格,意味着药企在研发阶段可以与FDA进行更频繁的会晤,在提交上市申请后如果符合相关标准则有资格进行加速审批和优先审查,以及滚动审查的机会。其中,滚动审查允许药企将其生物制品许可申请(BLA)或新药申请(NDA)中已完成的部分提交给FDA,而不必等到每个部分都完成后再审查整个BLA或NDA,所以新药能够得以迅速上市。
此次HQP1351能一举获得FDA孤儿药资格和FTD资格“两大资格”,显然充分说明FDA对亚盛医药产品质量和临床效果的认可。如此,HQP1351在美进行的临床试验将在一定程度上降低研发投入以及加快临床审批速度,有利于产品在美快速落地。
掘金千亿“孤儿药”蓝海
关于孤儿药认证,不少投资者仍有不解。因为在美国,罕见病定义为患者少于20万人病种的药物,因此有投资者担心药物收入或不能覆盖成本。
但事实上,很多罕见病药物市场远未达到饱和,甚至处于无药可医的状态(全球只有5%的罕见病有药可医),这就意味着孤儿药一旦研发成功,可迅速获取较大的“长尾市场”。正是如此,孤儿药已逐渐成为全球新药领域的全新研发方向,属于尚未有效发掘的蓝海市场。
从整体市场情况来看,全球孤儿药市场的业绩表现,较其他治疗领域表现优秀。EvaluatePharma统计数据显示,2017-2022年,预计孤儿药市场复合增长率为11.1%,远高于非孤儿药市场(复合增长率仅5.3%);到2022年,预计孤儿药的销售总额将达到2090亿美元,占全球药物销售额的21.4%。这也就意味着,孤儿药的市场表现届时将优于全球处方药市场。
目前正处在孤儿药市场发展的黄金时期。智通财经APP了解到,在孤儿药法案通过前,只有10种孤儿药品进入市场。但到2017年底,已有450多种用于668种罕见病适应症的产品获得FDA批准。并且细数当前孤儿药营收领域占据领先位置的企业,新基、强生、诺华、罗氏和默沙东等知名跨国药企均名列其中。这足以说明拓展罕见病领域研发”是目前药物研究的主流方向。
在此市场背景下,通过FDA的孤儿药认证对于HQP1351而言意义非凡,有利于其在CML治疗领域市场竞争中掌握更大的优势。
在CML治疗领域最著名的药物莫过于“神药”格列卫。
要知道,格列卫最初就是以“孤儿药”的身份获批上市,但就市场销售业绩而言,格列卫无疑是一款重磅药物。智通财经APP了解到,上市前3年,格列卫就实现了20亿美元的销量,此后价格更是以每年平均高于5%的势头上涨,2009-2016年均销售额更是稳定在40亿美元左右。截至2017年,格列卫单药的全球总销售额累计达到400亿美元。
格列卫的市场销售能力充分证明,即使被FDA列入孤儿药范畴,CML治疗市场空间依然巨大。目前,随着百时美施贵宝达沙替尼、诺华尼洛替尼的推出,第二代酪氨酸激酶抑制剂在CML的一线和二线治疗中已占据了重要地位。数据显示,这2款“二代格列卫”在2019年的销售额分别为21.1亿美元和18.8亿美元,总销售额达到39.9亿美元。按2019年全球畅销药排行名单来看,以此2款药物为主的CML药物销售额在全球抗肿瘤药中排位列前10位,市场广阔可见一斑。

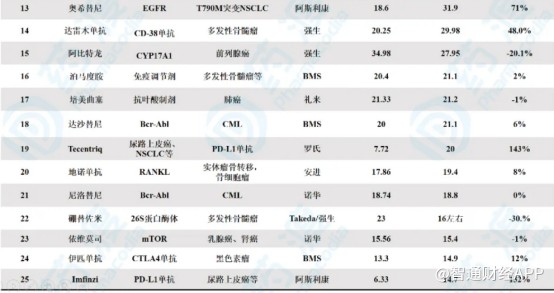
而HQP1351作为亚盛医药在研原创1类新药,可以有效克服一代、二代BCR-ABL抑制剂的耐药缺陷。HQP1351 I期研究初步结果曾在2018年ASH年会入选口头报告,2019年其更新临床数据则再次入选ASH年会口头报告。连续两年入选ASH年会口头报告,充分显示了国际血液学界对HQP1351疗效和安全性的认可,也从侧面说明一旦HQP1351获批进入市场将对一代、二代BCR-ABL抑制剂具备充分替代性。
所以此次在获得FDA孤儿药认证的同时还被授予FTD资格对于亚盛医药而言具有里程碑意义,可以极大推动HQP1351在美落地。一旦HQP1351获批上市,势必会抢占跨国药企CML药物市场份额。随着未来市场空间不断提升,HQP1351定将为亚盛医药带来持续且丰厚的利润回报。




 扫码下载智通APP
扫码下载智通APP