中金:核酸药物,时代已至
本文来自微信公众号“中金点睛”,作者:赵利建、何子瑜、邹朋。
近年,核酸药物的开发取得了较大的进展,多款药物已获批上市,多款潜在的重磅药物于近期公布了临床数据,核酸药物领域的并购、产品引进的交易也层出不穷。对此,我们对核酸药物的技术发展、优势、临床进展及重点公司进行了梳理。
摘要
近年核酸药物领域引发了较多关注。近年,核酸药物获批上市的速度呈加速趋势,多款有潜力成为重磅药物的核酸药物公布了临床数据,覆盖了心脏与代谢性疾病、肝脏疾病以及多种罕见病等领域,因此核酸药物引发了较多的关注,近年核酸药物领域的并购、产品引进交易在活跃进行。
核酸药物拥有明显优势。传统的小分子化药和抗体药物多是通过与靶点蛋白结合发挥作用,但是二者的研发受到靶点蛋白可成药性(druggable)的限制,据Nature报道,人类基因组编码的~20,000种蛋白质中,仅有3,000种是可成药的,且目前只有700种有相应的药物研发出来;而且抗体药物通常只能针对细胞膜和细胞外蛋白发挥作用。而核酸类药物是通过与蛋白质表达相关的基因进行调节,对细胞内外和细胞膜蛋白均可发挥调节作用,而且多数核酸类药物的作用基础是碱基互补配对原则,只需知道靶基因的碱基序列,核酸药物的序列设计就较为容易。
核酸药物有望成为继小分子化药和抗体药物后的第三大类型药物。核酸药物的研发经历了较长的历程,其不稳定性、免疫原性、细胞摄取效率低、内吞体逃逸难等缺陷曾限制了核酸药物的发展,但关键技术的突破对改善上述缺陷发挥了重要的作用,包括化学修饰、递送系统等。目前全球已有13款核酸药物获批,2种mRNA疫苗获得FDA的EUA,众多核酸药物在临床试验中,我们预计随着技术的不断改进,核酸药物有望成为继小分子化药和抗体药物后的第三大类型药物。
多种核酸药物技术路线齐驱并进。核酸药物的研发也分为多种技术路线,包括ASO、siRNA、Aptamer、miRNA、mRNA、saRNA、sgRNA、U1 snRNA等。1)ASO是单链结构,经过化学修饰可以有效改善其稳定性、免疫原性、半衰期等性质,且其呈两性分子(亲水和亲脂),对递送系统的依赖程度相对较低,可以以裸露核酸的方式进行给药,目前已经获批的13款核酸药物中有7款均为ASO类药物。2)siRNA是目前核酸药物的研究热点之一,其通过RISC诱导基因沉默的发生,递送系统技术的发展较大的促进了siRNA药物的发展,目前已经4款siRNA药物获批,多款有望成为重磅药物的siRNA药物已经公布临床数据。3)mRNA疫苗的研发受到卫生事件影响在近期受到了较多关注,并取得了较大的进展,2款mRNA疫苗已经获得FDA的EUA,同时,基于mRNA路线的蛋白替代疗法也在探索之中。此外,Aptamer、miRNA、saRNA、sgRNA、U1 snRNA等类别的核酸药物的研发均在较快的进行中。
风险
药物研发失败,临床试验发生较大的安全性问题,技术升级更新迭代风险。
正文
核酸药物引发关注
mRNA疫苗的研发受到关注。发生卫生事件之后,mRNA疫苗的开发受到较多关注。mRNA-1273是全球首个进入临床试验的疫苗之一,从公布基因序列到制成首批样品仅花了27天,其III期临床的最终分析数据显示对卫生事件的保护效力为94%,对重症患者的保护效力为100%。BioNTech的mRNA疫苗BNT162b2是全球第一个公布III期临床结果的疫苗,其最终分析数据显示的保护效力为95%,对65岁以上人群的保护效力也达到了94%以上。同时,在癌症治疗领域,mRNA疫苗同样具备潜力,Moderna(MRNA.US)于11月11日宣布其个性化癌症疫苗mRNA-4157在与K药联用的I期临床中对头颈部鳞状细胞癌的ORR达到50%,DCR达到90%。卫生事件的发生、mRNA疫苗的研发较大地提升了投资者对mRNA疫苗的关注度,全球三大mRNA疫苗研发商均在股票市场取得了较好的表现。
图表:Moderna、BioNTech、CureVac上市后股价
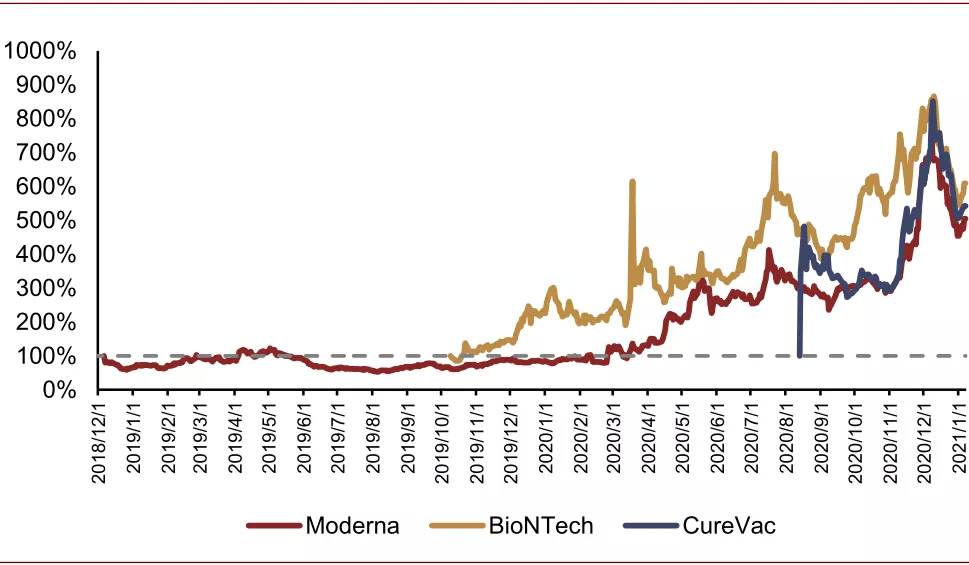
资料来源:wind,中金公司研究部
除mRNA外,核酸药物的研发也在近年取得较多关注。2018年,全球第一款siRNA药物(Patisiran)获批,是第一个采用LNP递送系统的核酸药物;近年核酸药物的上市速度也呈加快趋势,2018-2020年共有4款siRNA药物、3款ASO药物获批(FDA和EMA)。此外,Aptamer、miRNA等领域也都有较多药物正处于临床阶段。
核酸药物领域的交易也在活跃进行。近年,核酸药物领域的并购交易以及产品授权引进的案例也在活跃进行。2019年,Novartis以97亿美元的估值收购了The Medicine Company,主要获得一款Inclisiran产品的权益;同年,Roche以2亿美元首付款和14.7亿美元的里程碑付款加销售分成lincense-in了Dicerna一款处于I期临床的治疗慢性乙肝的药物;Pfizer以2.5亿美元首付款和13亿美元里程碑和双位数销售分成引进了Akcea的一款处于II期临床的治疗心血管和代谢性疾病的药物;同时近年也发生了多款心血管和代谢性疾病、乙肝等领域的交易案例。
图表:近年核酸药物交易案例
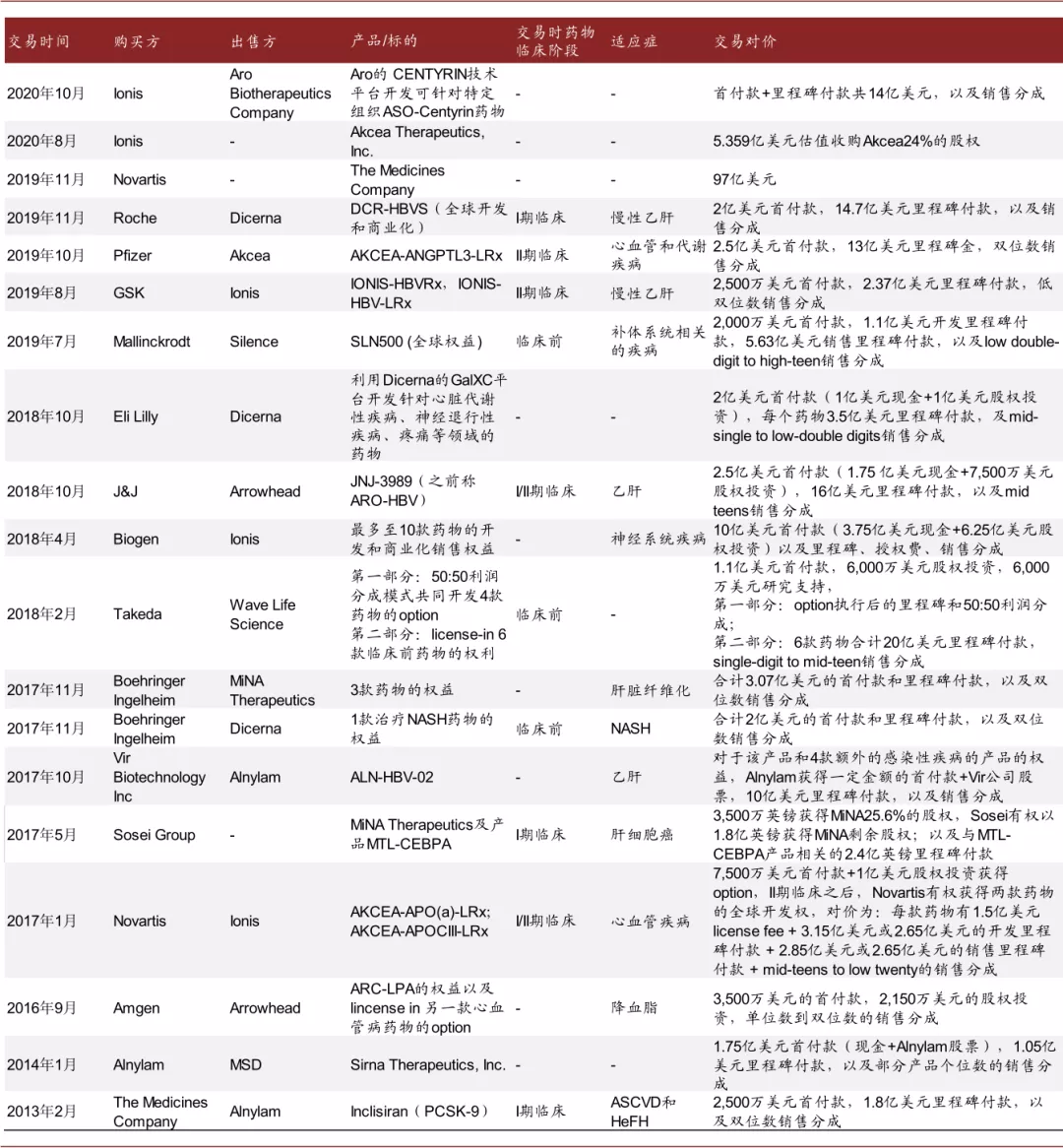
资料来源:公司官网,Capital IQ,中金公司研究部
核酸药物:新一代药物开发技术
核酸药物的研究和发现已经历了较长历程
核酸药物的研究和发现经历了较长的历程。mRNA作为遗传信息传递的载体于1961年被发现,其由DNA转录而来并指导蛋白质的翻译;1978年哈佛大学科学家发现用一段互补的核苷酸链可以抑制RSV病毒的复制活动,即ASO(antisense oligonucleotide,反义核酸)的概念;1990年Science和Nature分别报道了在体外筛选出可以与目标蛋白分子亲和力较强的RNA链(RNA aptamer,RNA适配体),同年发现在给小鼠体内注射mRNA可以使其表达相应的蛋白;1998年第一款ASO药物获批,同年RNAi(RNA interference,RNA干扰)的作用机理被揭示;2004年第一款RNA aptamer药物获批;2018年第一款基于RNAi的药物siRNA(small interfering RNA)获批。
核酸药物的研发经历过低谷。核酸药物的研发过程并非一帆风顺,外源的核酸药物想要进入体内发挥作用需要克服多重阻碍:1)不稳定,且易被体内的核酸酶降解;2)核酸分子具有免疫原性,会激活人体免疫系统的反应;3)核酸药物分子结构较大,且带有负电荷,穿透细胞膜的难度较高;4)核酸分子进入细胞后需要从内吞体中逃逸至细胞质中(endosome escape)。2010年前后核酸药物因为免疫原性和递送系统的问题屡遭挫折,Novartis和Roche中止了和Alnylam的合作,Pfizer和Abbott中止了RNA药物的研究项目,2012年EMA由于肝脏和心血管的副作用拒绝了Mipomersen的上市申请,MSD于2014年将Sirna以低于原收购价的价格出售给Alnylam。
关键技术的突破促进核酸药物的发展。鉴于核酸药物在体内递送过程中遇到的局限,多种措施被应用以尝试解决上述问题,其中较为重要的是核苷酸的化学修饰和递送系统的应用,通过对核苷酸进行化学修饰可以提高核酸分子的稳定性并降低其免疫原性,递送系统技术的发展在使得避免核酸药物被核酸酶降解的同时提升其进入细胞的效率。关键技术的突破和持续不断的研究使得核酸药物产业继续蓬勃发展。
图表:核酸药物发展历程
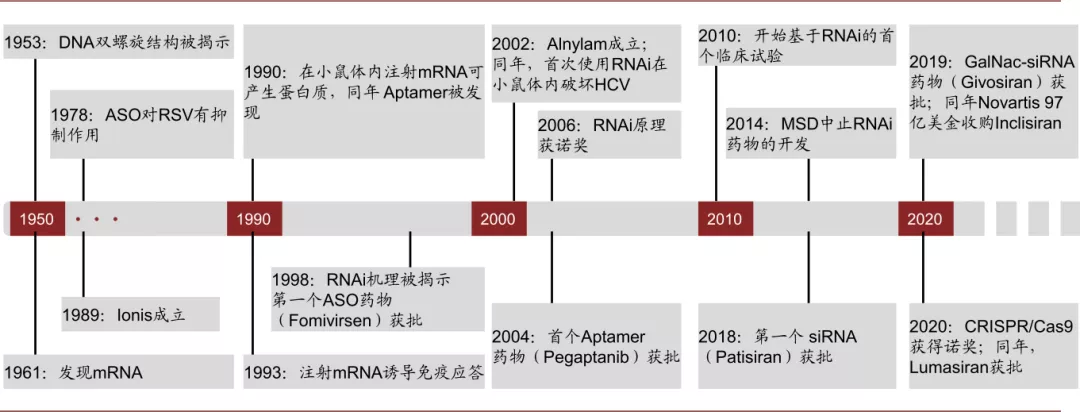
资料来源:PubMed,FDA,公司官网,中金公司研究部
核酸药物相比小分子和抗体药物拥有明显优势
小分子化药和抗体药物通过与靶点蛋白结合发挥治疗作用,但可成药的靶点蛋白数量有限。自上世纪80年代后,基于靶点的新药研发逐渐展开,并发现了大量的新药;传统的小分子化药和抗体药物均是通过与靶点蛋白结合而发挥药理作用,靶点蛋白可以是酶、受体、离子通道等。尽管小分子化药有易生产、可口服给药、药代动力学性质更佳、易通过细胞膜等优势,但是其研发受到靶点可成药性(druggable,与靶点蛋白是否有合适的口袋结构、大小、深浅、极性等有关)的限制;据Nature 2018的一篇文章报道[1],人类基因组编码的~20,000种蛋白质中,仅有3,000种是可以成药的,且只有700种有相应的药物研发出来(以小分子化药为主)。
图表:人类基因组所编码的蛋白质靶点开发程度分布

注:GPCR, G protein-coupled receptor;1包括40种转录因子;. 2 不包括激酶
资料来源:PubMed,中金公司研究部
抗体类药物可作用的靶点位置受到限制。在小分子药物之后,以抗体药物为主的生物药逐渐出现,与小分子化药相比,抗体药物可作用的靶点蛋白种类更多,且可通过蛋白质工程技术提升其亲和性降低毒性等。但是抗体类药物拥有分子结构更加复杂、生产成本更高、通常需通过注射给药等劣势,并且抗体药物通常只能与细胞膜表面或细胞外的蛋白质发挥作用,使得其应用受到一定限制。
相比之下,核酸类药物拥有明显的优势。核酸类药物可基于碱基互补原理对表达相关蛋白质的基因进行调节,如ASO、siRNA、miRNA、saRNA等,而非与靶点蛋白质进行结合,且通过合适的递送系统可使其进入细胞内发挥作用,因此核酸药物可避免传统小分子化药和抗体类药物面临的不可成药靶点的限制问题,而且对胞内外和细胞膜蛋白均可发挥调节作用。同时,多数核酸类药物的作用基础是碱基互补配对原则,只需知道靶基因的碱基序列,核酸药物的序列设计就十分容易,化学修饰和递送系统的设计与序列的设计是相对独立的;相比之下,小分子和抗体药物的发现和优化过程中,对活性、PKPD等性质的优化均需要对结构做改动,需要花费大量的工作。
此外,核酸药物拥有更广的作用范围。在哺乳动物的基因组中,约70%-90%的DNA会被转录为RNA,但并非所有的RNA均会被翻译成蛋白质,存在很多非编码RNA(non-coding RNA),实际上,只有不足3%的DNA会最终表达为蛋白质,而非编码RNA在生命活动的调节中发挥着重要作用。
关键问题的突破促进了核酸药物的发展
核酸药物发挥作用需要克服重重阻碍。外源核酸药物想要进入体内发挥作用,需要克服重重阻碍,这些阻碍曾经也使得核酸药物的研发遇到难题,但随着新技术的发展,部分难题已经有较好的解决办法,其中化学修饰和递送系统技术的突破对核酸药物的发展起到了至关重要的作用。
图表:递送难题及解决办法

资料来源:PubMed,中金公司研究部
化学修饰:改善核酸药物的稳定性和免疫原性
化学修饰可增强核酸药物的稳定性和降低免疫原性。由于核酸的不稳定性以及人体内存在很多核酸酶,外源的核酸进入人体后很容易被降解,且易通过肾脏清除,半衰期较短;同时外源的核酸分子具有免疫原性,会引起人体的免疫反应;而对核苷酸进行的化学修饰可改善上述问题,包括对核糖、磷酸骨架、碱基以及核酸链末端等。
► 磷酸骨架:磷酸骨架最常用的化学修饰是硫代磷酸,即将核苷酸中磷酸骨架中的一个非桥氧用硫进行替代,PS改造基本不影响核酸药物的活性,但可以抵抗核酸酶的降解,而且该改造可增强其与血浆蛋白的结合能力,降低肾脏清除速率,提高半衰期。PS是第一代ASO药物中常见的化学修饰,现在依然经常在核酸药物中使用。但经过PS改造后,核酸药物与互补核苷酸链的亲和力会变差,因此需要后续的化学修饰来改善。
► 核糖:第二代的化学修饰主要集中在核糖的结构中,对核糖结构中2位的羟基/氢进行改造,常见的改造包括2’-OME(在siRNA中应用较少)、2’-OMe、2’-F,这些改造可进一步增强对核酸酶的抵抗,并可以增强其与互补核苷酸链的结合能力。
► 核糖五元环改造:对核糖的五元环进行改造被称为第三代的化学修饰,包括LNA(locked nucleic acid)、PNA(peptide nucleic acid)、PMO(phosphoroamidate morpholino oligomer),这些改造可以进一步增强核酸药物对核酸酶的抵抗、提高亲和力和特异性等。由于PNA和PMO为电荷中性,其与血浆蛋白结合能力较弱,因此容易被清除,半衰期较短,但其可以与一些基团共价结合以提高核酸药物进入细胞的效率,包括脂类、肽类、适配体、抗体以及GalNAc等。
► 碱基:核酸药物对碱基改造的耐受性较差,但对碱基的改造也在尝试中,如胞嘧啶甲基化可提高其解链温度(melting temperature),其已经被应用在ASO药物的设计之中。
► 末端改造:为避免核苷酸链被核酸外切酶降解,需要对核苷酸链末端进行保护,包括3’端添加反式胸苷(inverted thymidine),或者在末端添加软脂酸或偶联芳香化合物。
图表:核苷酸化学修饰
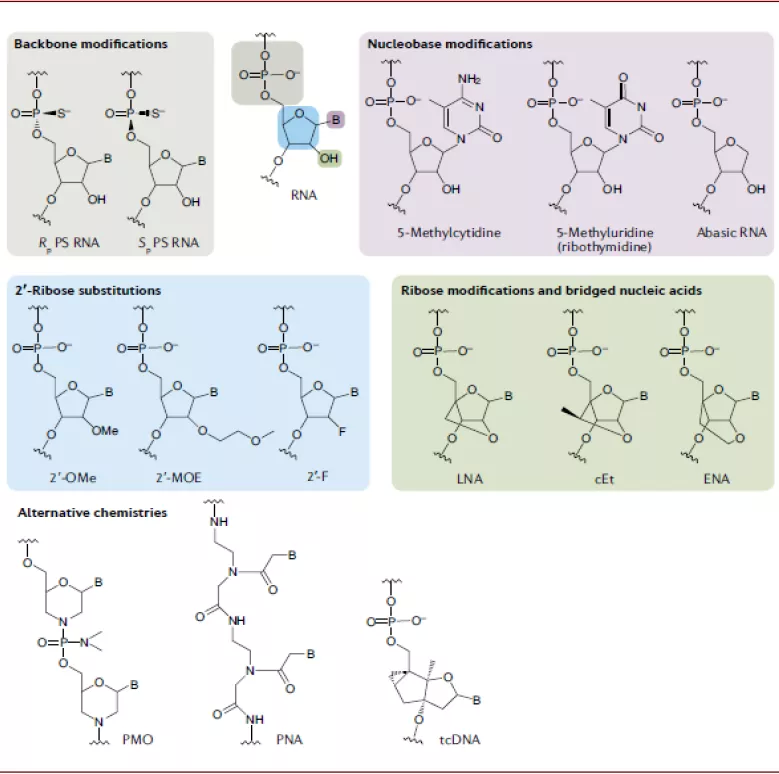
资料来源:PubMed,中金公司研究部
递送系统:提高细胞摄取效率
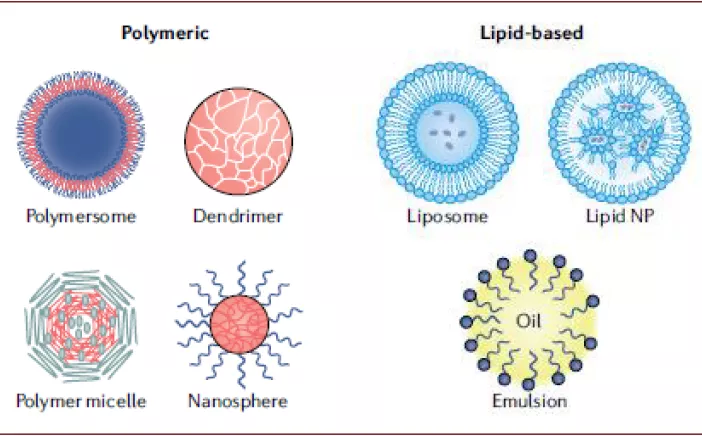
递送系统可提高核酸药物进入细胞的效率。尽管化学修饰可以改善核酸药物的稳定性和免疫原性,核酸药物需进入细胞内才可以发挥作用,由于核酸药物分子量较大且通常带负电荷,因此被细胞摄取的效率和内吞体逃逸的效率比较低,因此需借助递送系统的力量。递送系统可分为病毒载体和非病毒载体,病毒载体在基因治疗中应用较多,但由于其免疫原性、致瘤性、和有限的载药量(loading capacity)使得其在核酸药物中应用相对较少;而非病毒载体应用相对更多,如聚合物类(polymer)、脂质类(liposome或LNP);且可以将核酸药物与特定的配体结合使其能够靶向特定的细胞,如GalNAc、多肽、抗体等。
图表:核酸药物的递送系统
资料来源:PubMed,中金公司研究部
► 聚合物类:聚合物类递送系统也常用于药物递送,阳离子聚合物可中和核酸药物的负电荷以提升进入细胞的效率,聚合物可以进行多种化学改造,而且可以与多种药物或配体兼容(compatibility)。聚合物可以做成线状或分枝状,PEI(polyethyleneimine)被应用于siNRA药物的递送。
► 脂质类:是目前核酸药物中研究应用最多的递送系统之一,且已经有使用脂质纳米颗粒递送系统的核酸药物获批,根据其性质和结构的不同其可以分为脂质体(liposome)、脂质纳米颗粒(LNP,lipid nanoparticle)等,目前研究中用的较多的包括含有可离子化脂质的LNP等。
• 含可离子化脂质(ionizable cationic lipids)的LNP:含阳离子脂质的LNP的一个缺陷是会激起人体的免疫反应并会快速在血浆中被清除,为应付上述问题,可离子化的脂质纳米颗粒被开发出来,可离子化的脂质纳米颗粒在体液环境保持电荷中性,因此避免了被清除和过度激活人体免疫反应,当进入内吞体并被酸化时,可以离子化提高内吞体逃逸的效率。
图表:可离子化的脂质纳米颗粒结构

资料来源:PubMed,中金公司研究部
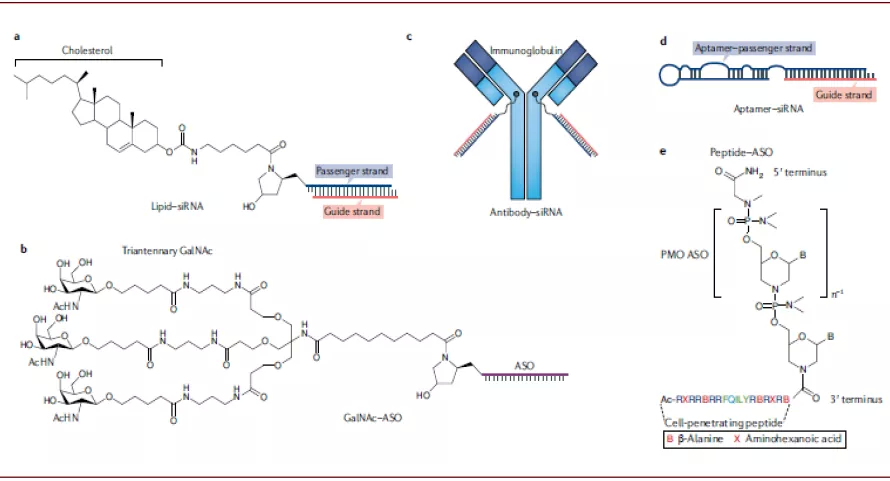
► 核酸偶联递送:尽管脂质类递送系统促进了核酸药物的发展,脂质类递送系统体积较大,更容易进入肝、肾的空隙较大的组织,且依然会有免疫原性,有时需与糖皮质激素类药物同时使用。核酸偶联递送是指将核酸药物与递送材料偶联,如胆固醇、多肽、抗体、核酸适配体或小分子结构等,利用递送材料的性质将核酸药物送至细胞内。
图表:核酸偶联递送系统
资料来源:PubMed,中金公司研究部
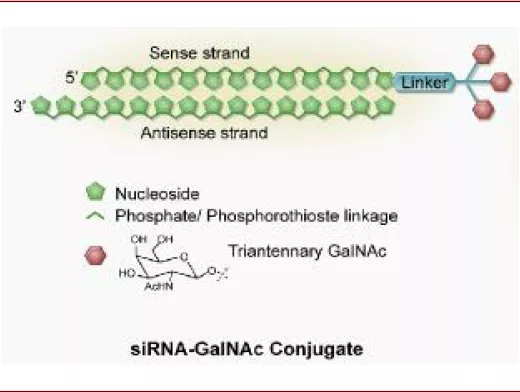
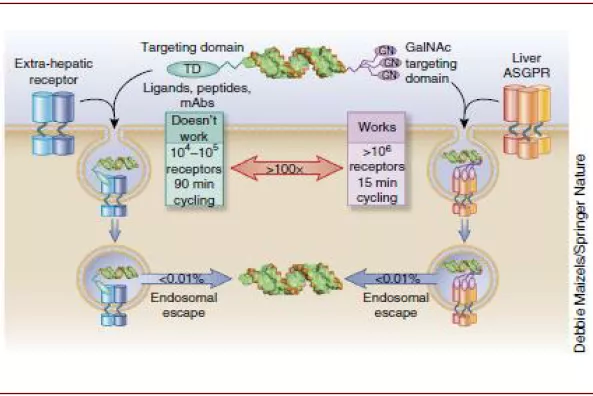
GalNAc是目前常用的核酸偶联递送系统之一。与脂质类载体相比,核酸偶联物分子量相对较小,因此体内生物分布的性质更佳,而且通过偶联物的设计可以使其靶向特定的组织和细胞,同时采用对酸敏感的linker设计可以使核酸偶联物在通过内吞体进入细胞之后与偶联物脱离。其中GalNAc是目前应用较为成功技术之一,已经有3款基于GalNAc技术的核酸药物获得FDA或EMA的批准。
图表:GalNAc结构
资料来源:PubMed,中金公司研究部
图表:GalNAc技术原理
资料来源:PubMed,中金公司研究部
除脂质体和核酸偶联递送系统之外,外泌体(exosome)、SNA(spherical nucleic acids)、DNA nanostructures等新型的递送技术均在探索之中。
内吞体逃逸:仍面临着瓶颈
核酸药物的递送最终都面临着内吞体逃逸的问题。无论是裸露的核酸药物,还是脂质体递送系统,又或是偶联递送系统,最终都是以内吞体的形式进入细胞内;核酸药物需要在细胞质中发挥作用,但核酸药物以内吞体进入细胞后,多数被“困”在内吞体内最终被降解,而无法顺利从内吞体中释放至细胞质中(体外试验显示1-2%的核酸药物能够进入细胞质中,体内试验不足0.1%)。
内吞体逃逸仍面临着瓶颈。尽管GalNAc递送技术的发现使得靶向肝脏的核酸药物的递送得到了较好的解决,但是其他组织中尚未发现与ASGPR类似表达量和循环利用速度的受体,因此需要其它方法来解决内吞体逃逸的问题。小分子药物(如氯喹等)在裂解包含核酸药物的内吞体的同时,也会裂解其他内吞体,从而产生毒性;Arrowhead曾尝试用蜂毒素(melittin peptide),但由于其本身的毒性而被搁置;其它在尝试的办法包括在递送系统中加入对pH敏感的聚合物或脂质体、CPP(cell penetrating peptide)等。
机遇与挑战并存
核酸药物有望成为继小分子化药和抗体药物后的第三大类型药物。随着临床的推进和相关技术的成熟,近年核酸药物获批速度明显加快,且目前众多不同种类核酸药物正在进入或已经在不同的临床阶段,其适应症也在更加广泛化,甚至治愈部分疾病;我们预计,随着更多困难被克服,将会有更多核酸药物得到临床应用,我们预计核酸药物有望成为继小分子化药和抗体药物后的第三大类型药物。
挑战与机遇并存。核酸药物的研发也面临着挑战,目前已经获批的药物的适应症多与肝脏等核酸药物容易聚集的组织相关(low-hanging fruit)或进行局部递送给药,未来应该通过递送技术的改进将其扩展至核酸药物更难到达的组织,以进一步扩展其适应症范围;而且目前核酸药物在细胞摄取效率、靶向递送、内吞体逃逸等方面仍面临着瓶颈,我们预计上述问题的改善将会引导核酸药物的发展进入新的阶段。
核酸药物分类:多种路线齐驱并进
ASO:当前获批药物数量最多的核酸药物
ASO是核酸药物的重要领域之一。ASO(antisense oligonucleotides,反义寡核苷酸,也简称为AON)是一种单链、寡核苷酸,通常包含15-25个核苷酸,ASO通过碱基配对原则与其互补的RNA结合,可以调节靶RNA的功能。ASO的作用自1978年被发现之后,其研究不断进步,目前成为核酸药物的重要领域之一,目前已经获批的13款核酸药物中有7款均为ASO类药物。
ASO作用机理多样。1)ASO与其互补的RNA结合后,可以招募RNAse H(一种核糖核酸内切酶)对靶RNA进行降解;2)ASO可以与mRNA的起始翻译位点结合,导致mRNA无法翻译;3)ASO可以通过与miRNA结合抑制miRNA的功能(anti-miRs);4)ASO与pre-mRNA结合后,可以改变剪接体(spliceosome)对pre-mRNA的剪接位置。
多种化学修饰措施改善了ASO的缺陷。ASO起初的形式是未经过化学修饰的RNA或DNA,尽管展示了初步的效果,但也有明显缺陷,包括容易被降解、亲和力较弱、脱靶毒性、带有负电荷导致无法有效穿透细胞膜、无法与血浆蛋白结合导致肾脏清除速率较快。为了克服上述缺陷,多种核苷酸化学修饰最终被成功应用(见前述章节)。
ASO对递送系统的依赖相对较低。ASO为单链寡核苷酸,经过一定的化学修饰之后,其在体内的稳定性、免疫原性、半衰期等均有所改善,并且呈两性分子(亲水和亲脂),因此在体内的生物分布和细胞摄取方面均相对更有优势,因此其也可以通过裸露的方式进行递送,对递送系统的依赖程度相对较低。
多款ASO药物已经获批。目前已经7款ASO药物已经获得FDA或EMA批准上市:
图表:已上市ASO药物
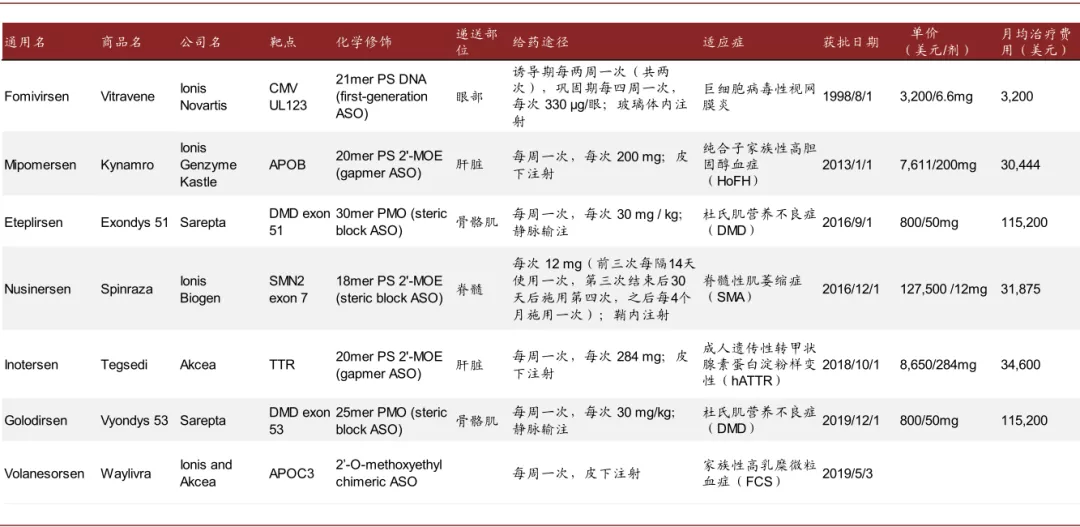
注:数据更新于2020年底
资料来源:PubMed,FDA,中金公司研究部
► Fomivirsen:第一款ASO是1998年FDA批准的用于治疗艾滋病患者的巨细胞病毒视网膜炎(cytomegalovirus retinitis)的Fomivirsen,其通过与特定mRNA(IE2)的结合可以抑制CMV部分蛋白(调节病毒基因表达的蛋白)的表达,从而抑制CMV的复制。Fomivirsen为21个核苷酸的单链DNA,采用了第一代的PS化学修饰,为裸露的DNA,未使用专门的递送系统,通过玻璃体内局部注射给药。一项开放的临床试验显示其可以将疾病的无进展时间延长至80天。后来高效抗逆转录病毒疗法(Highly Active Anti-Retroviral Therapy)的出现大幅降低了患者的数量,因此Novartis于2002和2006年分别取消了其在欧洲和美国的市场授权。
► Mipomersen:Mipomersen于2013年获得FDA批准用于降低纯合子型家族性高胆固醇血症(HoFH)患者的LDL-C、apo B、TC、non-HDL-C,其通过与Apo b-100 mRNA结合而抑制ApoB-100蛋白(载脂蛋白)的表达,从而降低LDL-C(low-density lipoprotein cholesterol)、VLDL等。Mipomersen为20个核苷酸长度,采用了PS和2’MOE的化学修饰,为裸露的寡核苷酸,通过皮下注射给药,其51例的III期临床结果显示可以显著降低LDL-C、ApoB-100、TC、non-HDL-C等指标,并可以提升HDL-C。但其肝脏副反应、流感样症状、注射部位疼痛等副作用使其在临床中的使用受到一定限制,其肝脏毒性在说明书中被加了黑框警告(black-box warnings)。
图表:Mipomersen临床结果
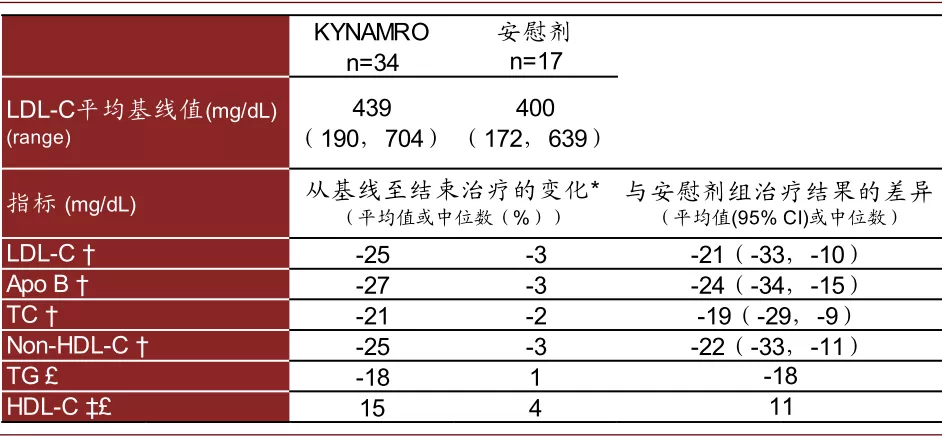
注:此表显示KYNAMRO作为add-on therapy的效果。* 治疗结束是指最后一次KYNAMRO给药后继续观察两周
资料来源:FDA,中金公司研究部
► Eteplirsen:Eteplirsen是第一款获批的使用PMO改造的核酸药物,于2016年获得FDA批准用于治疗DMD(duchenne muscular dystrophy),DMD是由于基因缺陷导致全身性肌肉进行性退化,Eteplirsen通过改变pre-mRNA的剪切位置(外显子51跳跃)使患者产生具有部分功能的抗肌营养不良蛋白(dystrophin protein),从而改善患者的症状。Eteplirsen为单链DNA,30个核苷酸长度,采用了PMO化学修饰,其也为裸露的寡核苷酸,通过静脉输注给药。Eteplirsen的获批也引起较大的争议,FDA是用加速审评批准了该药物的上市,批准其上市是基于12个病人的临床试验,主要临床终点为替代终点且改善幅度有限(患者体内抗肌营养不良蛋白的水平从正常人的0.16%提升至0.44%),6分钟步行试验的结果与安慰剂组并没有显著差异;随后随访3年的数据显示其可以显著减缓患者6 分钟步行试验得分的下降速度。
图表:Eteplirsen 临床结果
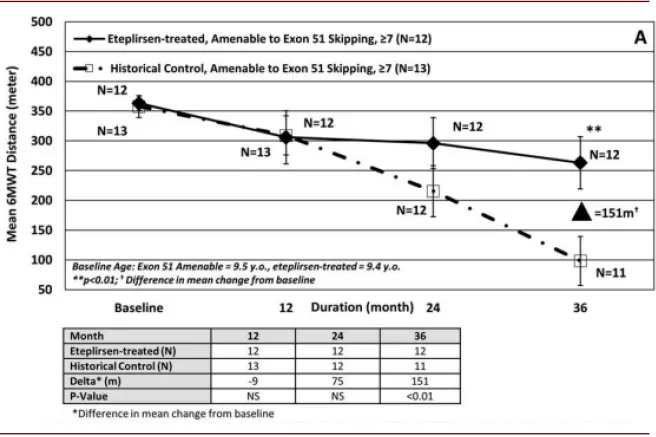
资料来源:PubMed,中金公司研究部
图表:Eteplirsen 销售额
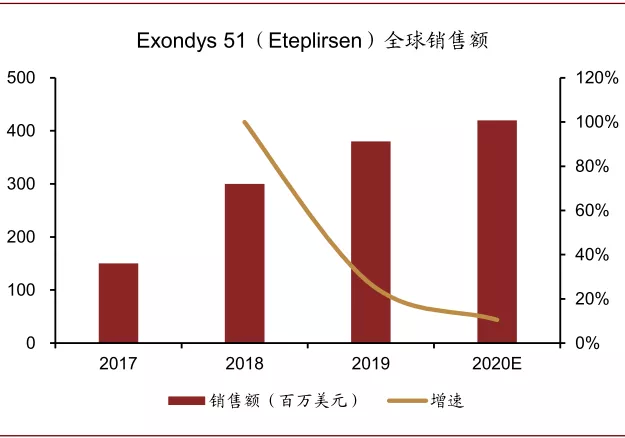
资料来源:PubMed,中金公司研究部
► Nusinersen:Nusinersen于2016年获得FDA批准用于治疗SMA(spinal muscular atrophy),SMA是由SMN1基因突变无法产生足够的SMN蛋白,导致运动神经元变性,患者近端肢体和躯干表现为进行性、对称性肌无力和肌萎缩,Nusinersen通过与SMN2 mRNA基因结合,保护其不被截断,使患者产生更多的SMN蛋白,从而改善症状。Nusinersen也为裸露的寡核苷酸,为18个核苷酸长度,其采用了PS和2’MOE的化学改造,通过髓鞘内注射给药,III期临床study 1结果显示其对改善婴幼儿期发病的患者的运动功能和生存状况均有效,III期临床study 2结果显示其可显著改善迟发性患者的运动功能。该药物上市之后的销售情况表现不错,2019年实现销售额21亿美元。
图表:Nusinersen临床结果
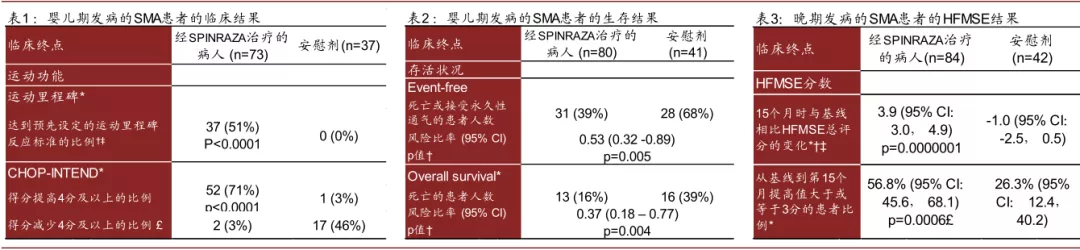
注:表1:† 在第183、302、394天进行评估;‡ 根据HINE第2部分的运动指标改善。表3:* 根据至少接受过一剂SPINRAZA/安慰剂的人群进行评估。
资料来源:FDA,中金公司研究部
► Inotersen:Inotersen用于治疗成人的hATTR(hereditary transthyretin-mediated amyloidosis),于2018年获得FDA批准,hATTR是一种罕见的遗传性神经疾病,患者TTR淀粉样变形并沉积在全身多个器官和组织,TTR淀粉样沉积物的逐渐积累会导致感觉、运动和自主神经功能障碍。Inotersen的原理为通过与野生型和突变型的TTR mRNA结合,从而抑制TTR蛋白的生成,降低TTR淀粉样变性的积累。Inotersen也为裸露的寡核苷酸,20个核苷酸的长度,通过皮下注射给药,III期临床结果显示患者的神经功能和生活质量均可从其治疗中获益。但其血小板减少症和肾小球肾炎的副作用在说明中被加了黑框警告(black-box warnings)。
► Golodirsen:Golodirsen也用于治疗DMD,和Eteplirsen同为Sarepta公司的产品。与Eteplirsen类似,Golodirsen采用的也是PMO的化学改造,其也为通过改变mRNA的剪接位置从而产生截短但仍具有功能的抗肌营养不良蛋白,只是其作用位点为外显子53。Golodirsen同样采用裸露寡核苷酸的设计,为25个核苷酸的长度,通过静脉输注给药,FDA也是用加速审评批准了Golodirsen的上市,该II期临床入组了25个病人,主要临床终点为替代终点(抗肌营养不良蛋白水平),临床结果显示其可以提高患者体内的抗肌营养不良蛋白的表达量,治疗48周后从基线的0.10%(相对于健康人的水平)提升至1.02%。
► Volanesorsen:Volanesorsen用于治疗FCS(familial chylomicronemia syndrome,家族性高乳糜微粒血症),于2019年获得EMA批准上市,其通过抑制Apolipoprotein (ApoC-III)的生成来调节甘油三酯的代谢,III期临床结果显示其可以显著降低患者空腹甘油三酯的水平。但其会产生血小板降低的副作用,因此需要在治疗过程中对患者血小板水平进行监测。
图表:Volanesorsen临床结果
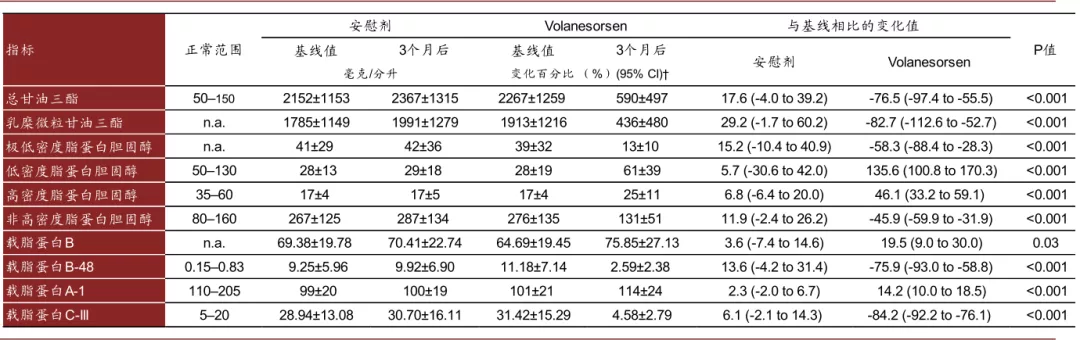
资料来源:FDA,中金公司研究部
众多ASO药物在研发中。鉴于多项技术的发展使得ASO药物性质有较大幅度改善,且多款ASO药物取得成功,ASO药物的研发正在如火如荼的进行,除上述已经获批的产品外,尚有多款ASO药物在研发中。
图表:在研ASO药物
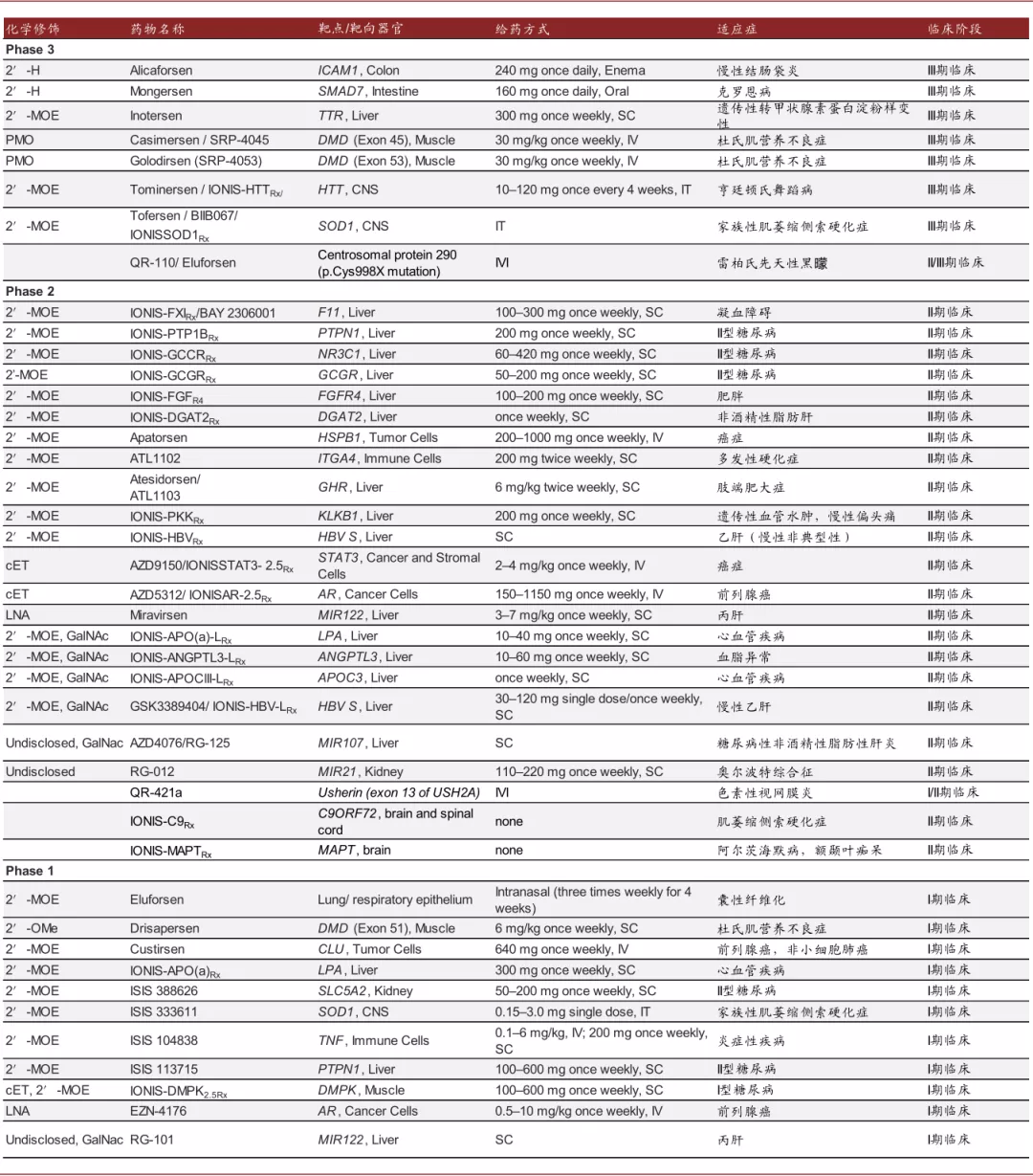
注:数据更新于2020年
资料来源:PubMed,中金公司研究部
► ION449/ AZD8233:近期Ionis和AstraZeneca共同开发的一款可降低LDL-C的ASO药物近期公布了I期临床数据,ION449/ AZD8233包含16个核苷酸,进行了化学修饰,与GalNAc进行了偶联,使得其能够靶向进入肝实质细胞,ION449/ AZD8233能够与PCSK9 mRNA结合,减少PCSK9的合成,PCSK9可以与LDL的受体结合诱导LDL受体的降解,从而提升血液循环中LDL-C的水平,降低PCSK9的合成即能降低体内LDL-C的水平。该产品的I期临床共入组了56个病人,根据剂量4-120 mg分为8组,结果显示,其安全性和耐受性良好,未发生SAE,血浆半衰期2-3周,其能够降低体内PCSK9和LDL-C的水平,并呈现剂量效应关系,最高可分别降低>90%PCSK9和70% LDL-C。同时,该团队探索了口服给药的可行性,发现兔子/狗的肝脏生物利用度可达到5%/7%。
图表:ION449/ AZD8233 I期临床数据
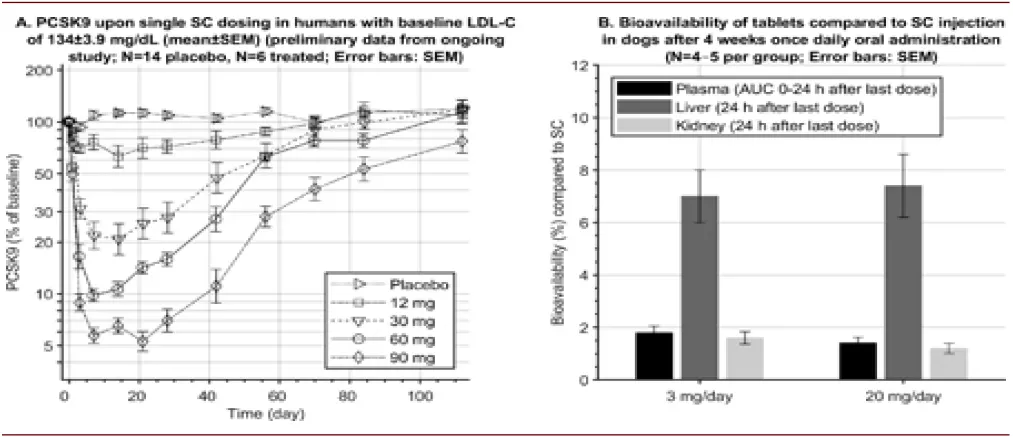
资料来源:PubMed,中金公司研究部
► IONIS-PTP-1BRx:Ionis曾研发一款针对II型糖尿病的反义核酸药物,IONIS-PTP-1BRx;该药物通过抑制PTP-1B(protein tyrosine phosphatase 1B)蛋白的合成而增强组织对胰岛素的敏感性;其在II期临床探索了其(200mg,每周1次)对使用二甲双胍±磺脲类药物无法有效控制血糖的肥胖的糖尿病患者的安全性和有效性,结果显示其可以显著降低患者体内的糖化血红蛋白水平以及降低体重。
图表:IONIS-PTP-1BRx II期临床结果
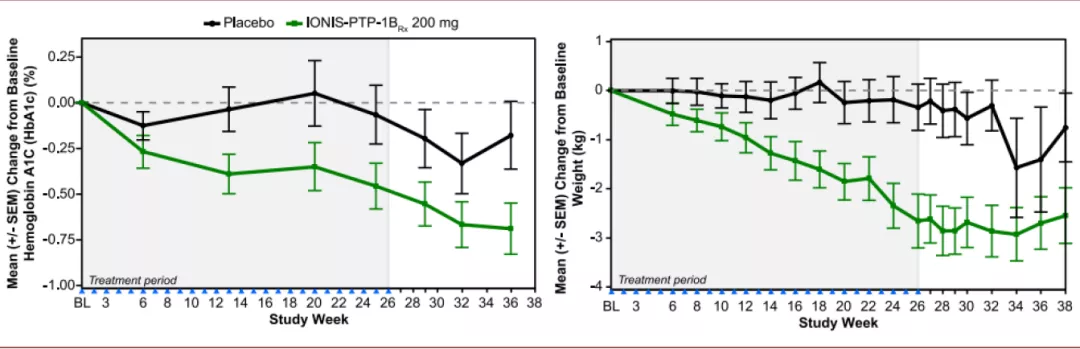
资料来源:PubMed,中金公司研究部
► IONIS-GCGRRx:IONIS-GCGRRx 是Ionis研发的另一款治疗II型糖尿病的药物,该药物共20个核苷酸,采用了PS和2’MOE的化学修饰,该药物通过靶向GCGR mRNA抑制GCGR(glucagon receptor)的生成,glucagon(胰高血糖素)是通过与细胞的GCGR结合而发挥作用。其II期临床结果显示在二甲双胍无法有效控制血糖的人群中,其每周给药一次可以显著降低患者的糖化血红蛋白水平。
图表:IONIS-GCGRRx II期临床结果
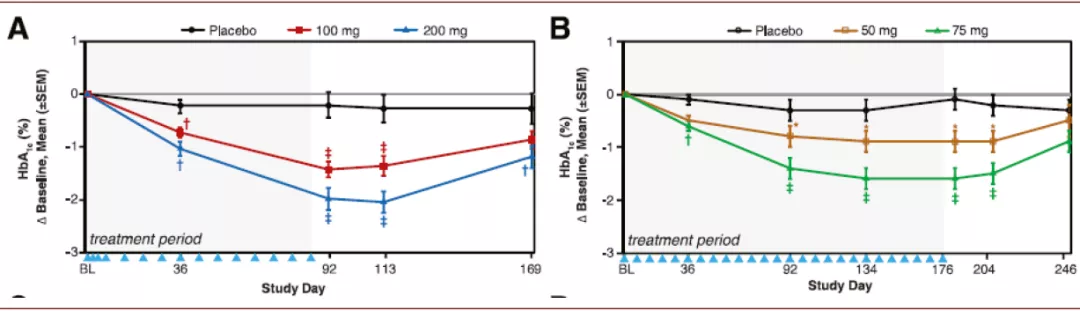
注:蓝色三角表示给药日期,灰色背景为给药阶段,白色背景为停药阶段
资料来源:PubMed,中金公司研究部
► IONIS-HBVRx/ GSK3228836:IONIS-HBVRx 是一款裸露的ASO药物,采用了2’MOE的化学修饰,可以靶向所有的HBV RNA,抑制乙肝病毒感染人体细胞和复制过程中相关蛋白质的生成,用于治疗乙肝病毒感染。其在一项II期临床中,在未接受任何治疗的慢性乙型肝炎患者中,其与恩替卡韦获替诺福韦联用,在IONIS-HBVRx给药6次后(4周内),患者体内HBsAg和HBV DNA明显降低,HBsAg降低可以维持至最后一次给药后的~3个月。
siRNA:诱导基因沉默的发生
siRNA是核酸药物领域的研究热点之一。自1998年RNAi的机理被揭示之后,RNAi药物的研发在过去20余年中经历了快速的发展,而后发现较短的双链RNA即可在动物细胞中发挥基因沉默作用,所以被称为siRNA,通常20-25对核苷酸的长度,是目前核酸药物领域的研究热点之一,2018年和2019年分别有1款siRNA药物获批,2020年2款siRNA药物获批,众多siRNA药物在研发中。
siRNA通过RISC诱导基因沉默的发生。外源的siRNA进入细胞之后与RNAi相关的酶TRBP、Dicer和Ago结合形成RLC(RISC-loading complex),随后siRNA双链结构中的sense strand脱离,anti-sense strand和可与其互补的mRNA结合形成RISC(RNA-induced silence complex),RISC中的mRNA被Ago 切断从而诱导基因沉默(gene silencing)。
siRNA更需要化学修饰和递送系统。siRNA为双链结构,分子量相比ASO更大,且呈亲水性,与血浆蛋白结合能力较弱导致清除速率较快,因此更需要合适的递送系统和化学修饰改善其在体内药代药动及生物分布的性质。已上市的4款siRNA药物采用了LNP或GalNAc的递送系统。
已有4款siRNA药物获批。目前已经有4款siRNA药物获得FDA或EMA批准上市:
图表:已获批siRNA药物
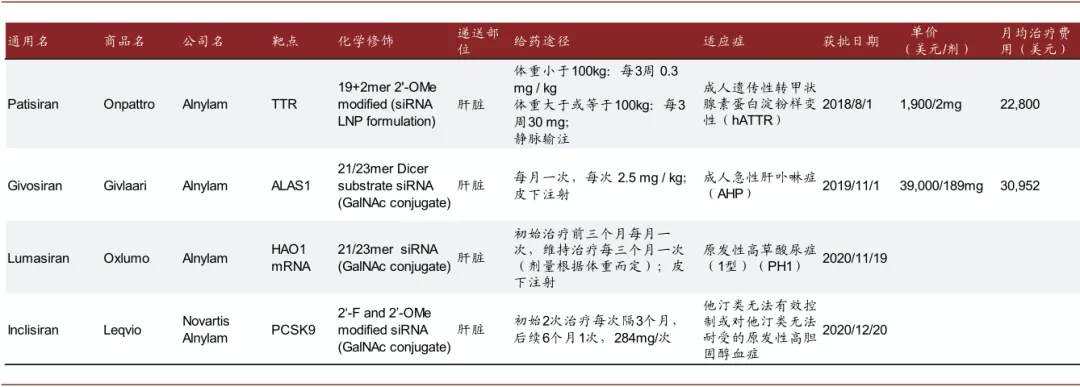
注:数据更新于2020年底
资料来源:PubMed,FDA,中金公司研究部
► Patisiran:Patisiran是2018年获批的第一款siRNA药物,治疗成人hATTR,与ASO药物Inotersen适应症相同,均在2018年获批,其原理是与表达野生型和突变型TTR的mRNA结合诱导基因沉默,减少TTR蛋白的产生,从而改善TTR淀粉样变性的累积。Patisiran为21对(19+2)核苷酸的长度,采用了2’OMe的化学修饰,并采用LNP的递送系统,III期临床结果显示使用Patisiran 18个月,相比于与安慰剂,可以显著改善患者的神经功能、生活质量和运动功能。由于需要控制相关不良反应的发生,因此使用Patisiran前需要使用糖皮质激素、对乙酰氨基酚以及抗组胺剂。其上市的第二个年度,2019年实现了1.7亿美元的销售额。
图表:Patisiran临床数据

注:mNIS, modified Neuropathy Impairment Score; QoL-DN, Quality of Life – Diabetic Neuropathy;† 数值越低表示损伤越小/症状越少;‡ 数值越高表示残疾/损伤越少;£ mBMI数值越高说明营养状况越好
资料来源:FDA,中金公司研究部
► Givosiran:Givosiran于2019年获得FDA批准用于治疗成人AHP(acute hepatic porphyria,急性肝卟啉症),AHP是一种罕见的遗传性疾病,是由于血红素生成过程中代表性酶的缺陷致使患者体内卟啉代谢产物蓄积引起神经性内脏症状。Givosiran的原理为诱导编码aminolevulinate synthase 1的基因沉默,减少ALA和胆色素原的生成,缓解卟啉或其前体的蓄积。Givosiran为21/23个核苷酸长度,其采用了PS、2’F 和2’OMe的化学修饰,其采用GalNAc的偶联载体,可以实现肝脏的靶向递送,III期临床结果显示其可以显著降低AHP的发生次数,并减少氯化血红素(治疗贫血)的使用。
图表:Givosiran临床数据

注:* 发作指:需要住院治疗、紧急医疗检查或在家静脉注射氯化血红素;‡ p < 0.0001;£ p = 0.0002
资料来源:FDA,中金公司研究部
► Lumasiran:Lumasiran于2020年11月获得FDA批准用于儿童和成年人原发性I型高草酸尿症的治疗。Lumasiran的原理为诱导编码hydroxyacid oxidase 1(HAO1)的mRNA的基因沉默,降低体内glycolate oxidase(GO)酶的生成,从而降低glycolate以及草酸盐的生成。Lumasiran为21/23个核苷酸长度,其采用了PS、2’F 和2’OMe的化学修饰,其采用GalNAc的偶联载体,可以实现肝脏的靶向递送,其III期临床结果显示其可以持续性显著降低患者尿液中草酸的含量。
图表:Lumasiran III期临床数据
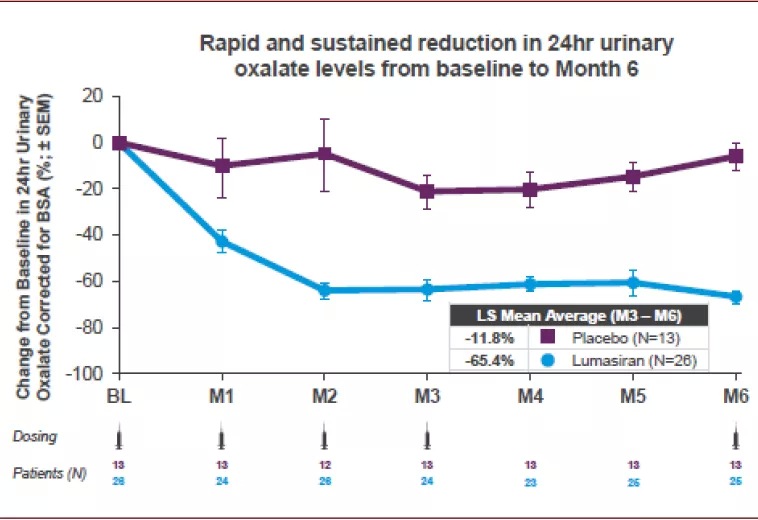
资料来源:FDA,中金公司研究部
► Inclisiran:Inclisiran于2020年12月获得EMA的批准上市,Inclisiran可以与PCSK9 mRNA结合,抑制PCSK9的合成;PCSK9通过阻止LDL受体的循环利用,参与LDL-C水平的调节,因此靶向PCSK9的单抗可以发挥降低LDL-C的作用,Inclisiran通过抑制PCSK9的合成也能实现降低LDL-C的效果,PCSK9主要在肝脏中合成,而Inclisiran采用了GalNAc的递送技术,可以实现肝脏的靶向递送,其采用了PS、2’F、2’OMe的化学修饰,与PCSK9单抗需要每2/4周注射一次不同,Inclisiran只需要半年注射一次(皮下)。其三项III期临床试验表明其可以显著降低患者体内的LDL-C的水平。
图表:Inclisiran III期临床结果
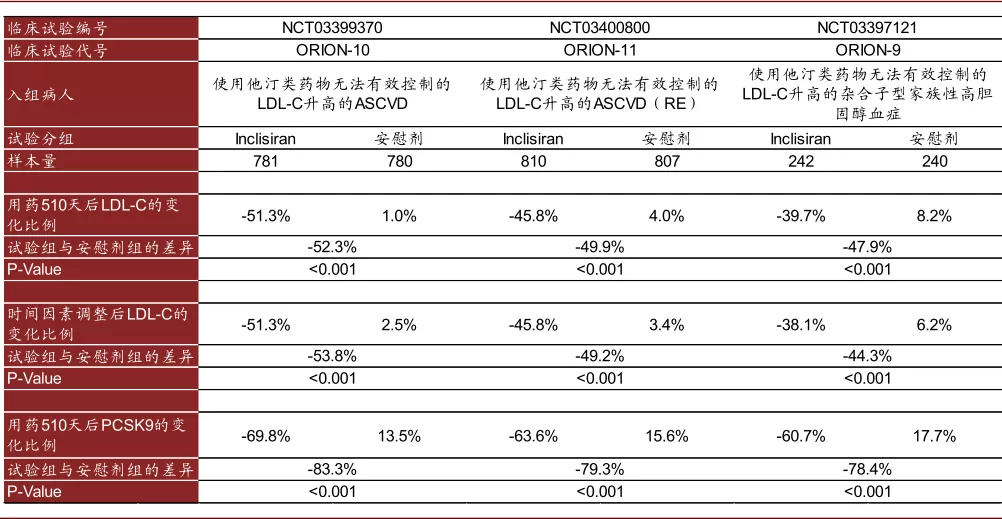
注:ASCVD=Atherosclerotic Cardiovascular Disease;RE=Risk Equivalents
资料来源:FDA,中金公司研究部
由于RNAi是生物体内会自然发生的现象,siRNA药物被大家认为拥有非常好的前景,目前多家企业在进行siRNA药物的研发,除上述获批的4款药物外,尚有多款siRNA药物在研发中。包括ALN-AGT01,一款有望实现三个月注射一次的降压药;Fitusiran,每月注射一次的血友病治疗药物;以及有望实现乙肝功能性治愈的药物JNJ-3989和VIR-2218等。
图表:在研siRNA药物

注:数据更新于2020年
资料来源:PubMed,中金公司研究部
► ALN-AGT01:ALN-AGT01也采用了GalNAc的递送技术,可以靶向递送至肝脏,ALN-AGT01可以诱导AGT(血管紧张素原)基因的沉默,从而减少血管紧张素的生成。其近期公布的I期临床结果显示,在皮下注射1针后,血清AGT降低>90%的效果可以至少维持3个月,第8周的血压结果显示其可以明显降低患者的舒张压和收缩压,且有明显的剂量效应关系;且该药耐受性良好,没有SAE的发生。
图表:ALN-AGT01 I期临床结果
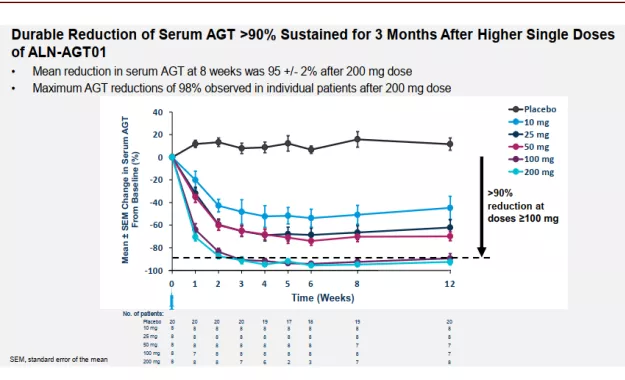
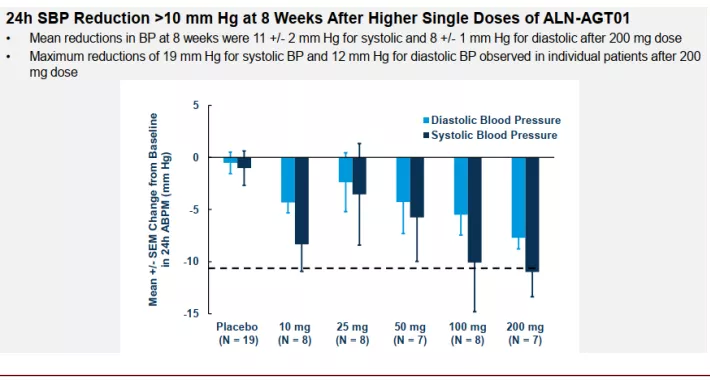
资料来源:PubMed,中金公司研究部
► Fitusiran:Fitusiran也采用了GalNAc的递送技术,其通过抑制AT(antithrombin,抗凝血酶)的生成来提升体内凝血酶的水平,用于治疗血友病(A和B),其去年公布的II期OLE(open label extension)临床数据(中位随访时间2.6年)显示每月1次皮下注射可以将患者体内凝血酶水平提升至健康人水平的下限;在存在凝血因子抑制物的患者中,年化出血率从42.0降至0.44,;在无凝血因子抑制物的患者中,年化出血率从2.0(预防治疗)和12.0(按需治疗)降至1.01。自2017年实行bleed management guideline之后,该产品的临床中未再出现血栓性事件。该产品目前在III期临床。
图表:Fitusiran II期临床结果
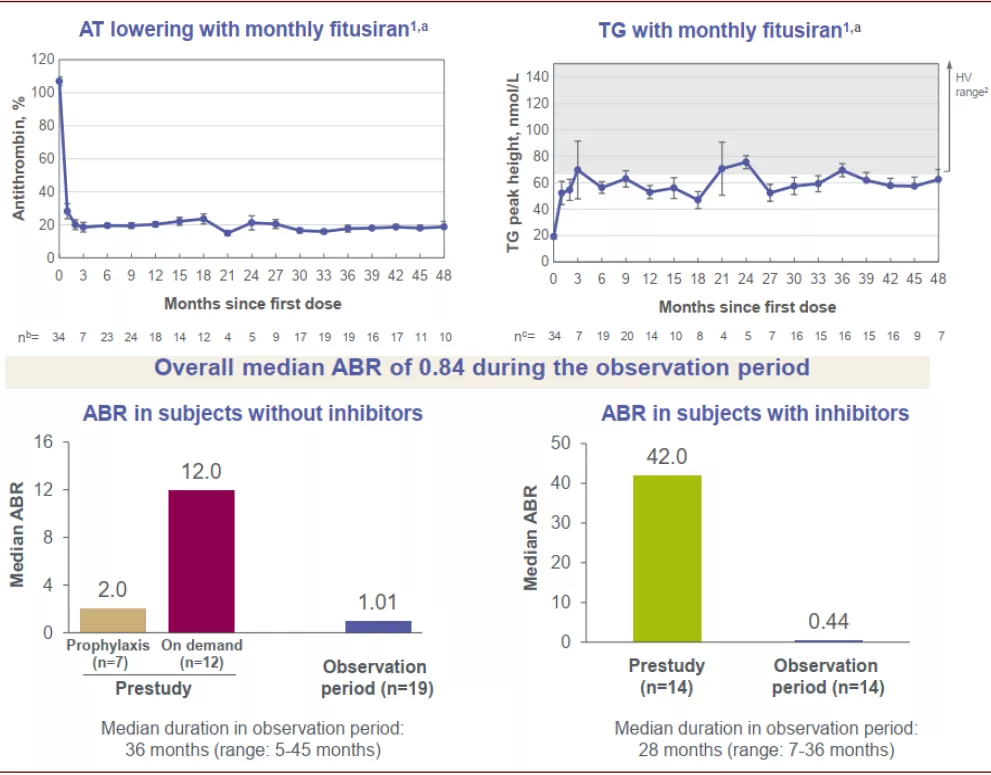
注:数据截至2020年3月10日。AT,antithrombin;HV,healthy volunteer;OLE,open-label extension;TG,thrombin generation;ABR,annualized bleed rate
资料来源:WFH,中金公司研究部
► JNJ-3989/ARO-HBV:JNJ-3989可以抑制乙肝病毒cccDNA转录的所有RNA,从而恢复机体自身的免疫功能从而清除病毒,我们预计有望实现慢性乙型肝炎的功能性治愈。该产品在一项I/II AROHBV1001期临床中展示了较好的安全性和有效性,通过每4周给药1次,共给药3次,联合核苷类药物对慢性乙型肝炎患者进行治疗,在JNJ-3989停药48周后,39%的患者实现了HBsAg降低了90%以上,部分患者的HBV RNA、HBeAg、HBcrAg也实现了持续性的降低。该产品目前在IIb期临床中探索与核苷类等其它药物联用以实现慢性乙型肝炎的功能性治愈。
► VIR-2218:VIR-2218也是一款我们预计有望实现慢性乙肝功能性治愈的药物,其靶向HBV X gene的一段保守序列,可以抑制所有乙肝病毒蛋白质的生成。其采用了Alnylam的ESC+和GalNAc的递送技术,在一项II期临床试验中,对接受核苷类药物治疗的慢性乙肝患者中,该产品显示了间隔4周注射2次后可以在24周内持续性的降低患者体内的HbsAg的水平。该产品与PEG-IFN-α或VIR-3434(一款HBV中和抗体)的联用方案在或将进入II期临床。
Aptamer:通过三维结构发挥作用
Aptamer通过其三维结构与配体蛋白质特异性结合。与ASO、siRNA、miRNA和saRNA等药物作用原理不同,Aptamer是利用其三维结构与其配体蛋白质结合,从而对蛋白质的功能进行调节,其可以是DNA也可以是RNA,通常是20-70个核苷酸,为单链结构,其特异性和亲和力可以到与单抗类似的水平,且其免疫原性低、生产成本低、具有高温稳定性等优势。
Aptamer有特定筛选方法。Aptamer通常用SELEX(systematic evolution of ligands by exponential experiment)进行筛选:先准备长度在20-100个核苷酸的随机寡核苷酸序列文库,将其与靶标蛋白孵育一定时间后,未结合的分子被移除,而结合的寡核苷酸序列在洗脱后经PCR扩增形成新的化合物库,重复该过程8-20次即可得到高特异性和高亲和力的Aptamer。
Aptamer的研发热度下降。Aptamer的原理于1990年被发现,2004年第一个Aptamer药物Pegaptanib获批,治疗新生血管性年龄相关性黄斑变性(wAMD),但面临着较强的单抗的竞争,同年bevacizumab获批(off label use可用于wAMD),2006年ranibizumab获批用于wAMD的治疗,2011年aflibercept获批wAMD适应症;而后Fovista(anti-PDGF)和Reg1(anti-FIXa)两款Aptamer药物失败,使得产业界对Aptamer的研发热度下降。
目前仅有Pegaptanib一款Aptamer药物获批。Pegaptanib是第一款也是唯一一款获得FDA批准的Aptamer药物,共28个核苷酸的长度,通过玻璃体内注射局部给药,未使用递送系统,进行了PEG化的修饰,其通过空间结构与VEGF从而结合抑制血管的生成,用于治疗生血管性年龄相关性黄斑变性,于2004年获得FDA的批准。但其上市后由于竞争激烈,且在疗效上未比抗体药物拥有优势,未获得商业化的成功。
图表:已上市Aptamer药物

资料来源:PubMed,FDA,中金公司研究部
miRNA:调节多种mRNA的表达
miRNA可调节mRNA的翻译过程。miRNA即微小RNA(microRNA),为单链RNA,通常15-25个核苷酸的长度,miRNA本身不编码蛋白质,但其可以与靶mRNA互补结合,调节其靶mRNA的翻译过程。目前已经发现~2,000种miRNA,一个miRNA可以调节上百个mRNA的翻译,miRNA可以调节细胞的分化、增殖等过程,研究中发现多种疾病的发生与miRNA异常表达有关,如肿瘤、肝炎、心血管疾病等,因此通过miRNA也可开发针对这些疾病的药物。
miRNA药物可分为拮抗剂和类似物。miRNA药物可分为两类:miRNA的拮抗剂(miRNA antagonist)以及miRNA类似物(miRNA mimics)。miRNA拮抗剂可以与miRNA以碱基互补配对原则结合并通过RISC对miRNA进行降解,以抑制miRNA的功能。miRNA类似物与人体内miRNA功能类似,将其导入病理细胞可是其恢复正常的生理功能。
目前尚未有miRNA药物获批。miRNA的发现至今约有20年的时间,虽然尚未有miRNA获批上市,但已有较多miRNA药物的研发进入临床试验阶段。miRNA药物研发也需要进行化学修饰和递送系统的帮助。
sgRNA:CRISPR/Cas9的组成部分
sgRNA是CRISPR基因编辑工具的核酸部分。CRISPR/Cas9是目前最热门的基因编辑工具之一,CRISPR/Cas9基因编辑系统包括sgRNA(single guide RNA)和Cas9核酸酶(有的CRISPR工具采用Cpf1核酸酶),sgRNA引导Cas9(或Cpf1)核酸酶对特定的基因位点进行双链切割,以实现引入点突变、基因插入或删除等对基因实现定点编辑,从而纠正致病基因或引入有益的基因,达到治疗疾病的目的;sgRNA为单链RNA,约20个核苷酸的长度。除Cas9/Cpf1核酸酶外,还可以设计可以翻译为相应核酸酶的mRNA与sgRNA一起递送。
CRISPR/Cas9相比ZFN和TALEN更有优势。目前用于基因编辑的工具有三种:ZFN(Zinc Finger Nuclease)、TALEN(Transcription-Activator Like Effector Nuclease)和CRISPR/Cas。CRISPR/Cas系统虽然出现时间较晚,但是其效率更高、速度更快、结构更加简单、成本更低。
U1 snRNA:pre-mRNA的剪接
U1 snRNA在pre-mRNA的剪接中发挥着重要作用。U1 snRNA是一种单链RNA,约164个核苷酸长度,包含4个茎环结构,通过与7个Sm(Smith antigen)蛋白和3种U1蛋白(U1A、U1C、U1-70K)形成核糖核蛋白(RNP,ribonucleoprotein)复合物发挥作用。U1 snRNA在pre-mRNA的剪接中发挥着重要的作用,其通过与pre-mRNA 5’ 端的特定序列(内含子和外显子的界限处)识别并进行剪接活动。
saRNA:激活基因表达
saRNA通过上调部分基因的表达发挥作用。RNAa(RNA activation)是由小分子双链RNA靶向作用于基因启动子/增强子等区域,在转录水平上调基因表达水平的现象,具有激活功能的小dsRNA被称之为saRNA(small activating RNA)。1969年,Britten等发现基因组非编码区转录出的RNA能够激活一类基因的表达,并提出激活RNA的概念;2006年,saRNA才被李龙承等人正式发现并命名。
saRNA与siRNA结构相似,作用相异。saRNA为~21对核苷酸的双链RNA,其结构与siRNA较为类似,但效应却相异。saRNA激活基因表达的作用机制尚不完全清楚,与Ago蛋白和核小体结构中的组蛋白相关,saRNA与Ago2蛋白结合后会移除passenger strand形成saRNA-Ago2复合物,既而招募RHA和CTR9形成RITA(RNA induced transcriptional activation)复合物,在相应基因启动子/增强子等区域,anti-sense strand会和靶序列互补结合,通过RNA聚合酶II的作用增强相应基因的表达。
图表:saRNA与siRNA对比

资料来源:PubMed,中金公司研究部
mRNA:疫苗领域取得较大进展
mRNA药物/疫苗拥有较大的潜能。1990年,Wolff等人发现在小鼠肌肉组织中注射含有特定基因的质粒DNA或mRNA,小鼠组织局部会产生该基因编码的蛋白产物,此后mRNA药物/疫苗的研发也得到重视。理论上mRNA拥有合成任意一种蛋白的潜能,因此mRNA可作为蛋白质补充或替代疗法治疗多种疾病;且一个mRNA可以表达多种蛋白质,从而实现联合用药;mRNA的生产成本较重组蛋白药物更低;在靶点得到确证之后,mRNA药物/疫苗的设计和发现速度非常之快。在目前核酸药物普遍遇到的递送技术问题得到较好的解决之后,我们预计mRNA药物/疫苗的潜能有望进一步释放。
目前mRNA的研发主要集中在疫苗领域。由于目前递送技术等方面还存在一些缺陷,mRNA的研发多数集中在疫苗领域;1)蛋白替代疗法相比疫苗对蛋白表达量要求更高,而疫苗只需要相对更少量抗原的表达即可激活人体免疫系统;2)蛋白替代疗法通常需要持续性的蛋白表达,因此可能需要频繁给药,而疫苗只需要少数几次即可;3)mRNA分子本身具有免疫原性,更加有利于疫苗作用的发挥;4)蛋白替代疗法需要蛋白质进行正确的翻译后修饰,修饰过程在不同细胞可能有不同的结果,因此需要将mRNA递送至正确的细胞中才能发挥较好的效果,而目前靶向递送还较难实现。
mRNA已在疫苗中实现较大进展。在应对卫生事件中,mRNA疫苗做出了较大的贡献,也在此次卫生事件中实现了较大的进展,目前美国FDA授权EUA的两款疫苗均为mRNA疫苗,二者在临床试验中初步显示了较好的有效性和安全性,III期临床结果显示的保护效力达到95%和94%,主要不良反应为轻中度,SAE发生率较低。同时CureVac所研发的针对的mRNA疫苗也已经开始IIb/III期临床。
mRNA在蛋白替代疗法中的应用也在探索中。理论上mRNA拥有翻译为任何一种蛋白质的可能,因此除疫苗外,mRNA作为蛋白替代疗法也在探索中。尤其是使用编码抗体的mRNA进行免疫治疗,多款产品已经进入临床前或临床阶段;相比于每次注射抗体一次性给药,mRNA进入人体后的翻译可持续数天,因此有望降低给药频率;且mRNA可以进入到细胞内,因此可以编码针对细胞内靶点的抗体;同时,mRNA可以编码多种抗体,生产能够编码多种抗体的mRNA比直接生产多种抗体更加简便。
图表:编码抗体的mRNA药物研发进展
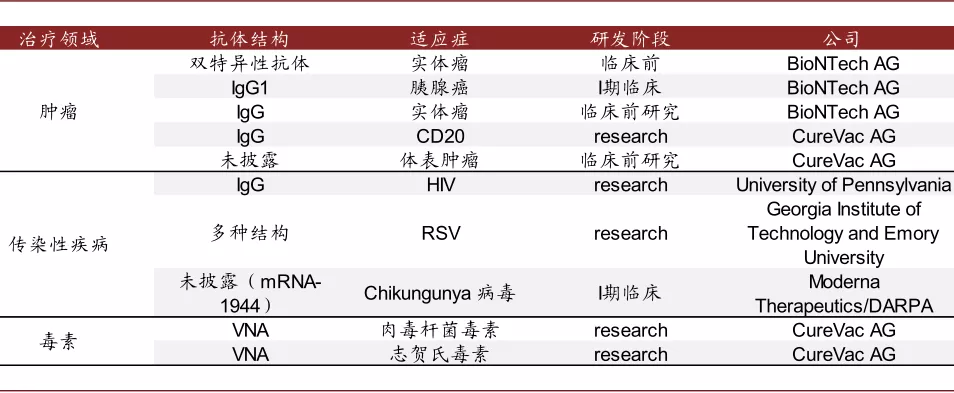
资料来源:PubMed,公司官网,中金公司研究部
关于mRNA疫苗更详细的介绍请参考中金医药团队2020年3月份发布的报告《mRNA疫苗:疫苗产业的新星》。
除上述核酸药物外,其它类型的核酸药物也在研发中,随着对瓶颈问题的突破,我们预计核酸药物有望迎来快速的发展,成为继小分子化药和抗体药物后的第三大类型药物。
关于国内外核酸药物领域相关的主要公司介绍,请参考正式报告。
附录
图表:已获批核酸药物汇总

注:数据更新于2020年底;未包括两款获得FDA EUA的 mRNA疫苗
资料来源:PubMed,FDA,EMA,中金公司研究部
图表:RNA生产方法的对比

资料来源:PubMed,中金公司研究部
(编辑:张金亮)




 扫码下载智通APP
扫码下载智通APP