亚盛医药-B(06855)年报亮点:商业化在即规模增长路径已清晰,细胞凋亡管线进入全面推进期
核心产品商业化进入倒计时,细胞凋亡管线研发取得全面进展。2020年财报透露出的这一信息,让市场目光再次聚焦于亚盛医药-B(06855)。
智通财经APP了解到,3月31日,亚盛医药公布了其2020年年报。财报显示,2020年,亚盛医药研发开支达到5.65亿元(人民币,单位下同),同比增长21.7%。
实际上,身为国内知名的创新药研发企业,亚盛医药近年来一直保持着高歌猛进的姿态,在加速核心候选药物奥瑞巴替尼(HQP1351)上市进程的同时,还在不断推进细胞凋亡管线的研发进度,逐渐构画起一幅庞大的创新制药版图,而公司的价值曲线也正随之向上攀升。
奥瑞巴替尼上市进程稳步推进 布局商业化规模变现可期
对于一家即将步入商业化阶段的创新药企业而言,公司的投资价值不仅体现在对创新研发管线的持续投入上,还体现在研发成果转化后的商业化能力上。
核心候选产品上市进程稳步推进,商业化布局陆续启动,从亚盛医药年报中披露的最直观信息,投资者不难探寻其中的企业成长确定性和中长期投资价值。
以公司核心候选产品奥瑞巴替尼为例,作为一款针对格列卫耐药研发的第三代Bcr-Abl/KIT抑制剂,奥瑞巴替尼能够靶向不同种类的Bcr-Abl突变体,可以有效克服一代、二代BCR-ABL抑制剂的耐药缺陷。初步数据显示,奥瑞巴替尼耐受性好,疗效显著,特别是对T315I突变的CML患者具有突出的疗效。
2020年以来,奥瑞巴替尼的上市进程一直在稳步推进,并取得了重要的阶段性成果。
去年6月18日,亚盛医药宣布公司已向国家药监局新药审评中心(CDE)提交奥瑞巴替尼的新药上市申请,用于治疗伴有T315I突变的慢性髓性白血病(CML)慢性期和加速期患者。
这是公司创立以来的首个新药上市申请,奥瑞巴替尼也有望成为国内首个上市的第三代BCR-ABL抑制剂。
值得注意的是,在国内正式进行上市申请前,奥瑞巴替尼I期研究初步结果便曾在2018年ASH年会入选口头报告,2019年其更新临床数据则再次入选ASH年会口头报告。
而在2020年,奥瑞巴替尼于5月相继获得了FDA孤儿药资格认定和快速通道资格(FTD);同年10月,奥瑞巴替尼被CDE纳入优先审评,用于治疗TKI耐药后并伴有T315I 突变的CML慢性期或加速期的成年患者:同年12月,奥瑞巴替尼的临床试验进展第三次入选ASH年会口头报告。这无疑显示了国际血液学界及权威机构对奥瑞巴替尼疗效和安全性的充分认可。
从最新的新药上市进展来看,今年3月30日,奥瑞巴替尼正式被国家药监局新药审评中心(CDE)纳入“突破性治疗品种”公示名单。这是奥瑞巴替尼继去年10月获得CDE授予的优先审评资格之后的又一重大进展,并且此次拟纳入突破性治疗品种的适应症为之前适应症的扩展。
不难看出,奥瑞巴替尼现已达到了新药上市的关键性节点,其未来市场潜力也预计将在其上市后转化为公司估值的真金白银。
据智通财经APP了解,作为治疗伴有T315I突变的慢性髓性白血病(CML)的特效药,奥瑞巴替尼面对的全球CML市场规模在2030年将增至58亿美元,而在中国的CML药物市场到2023年市场规模将预计增长至142亿元。
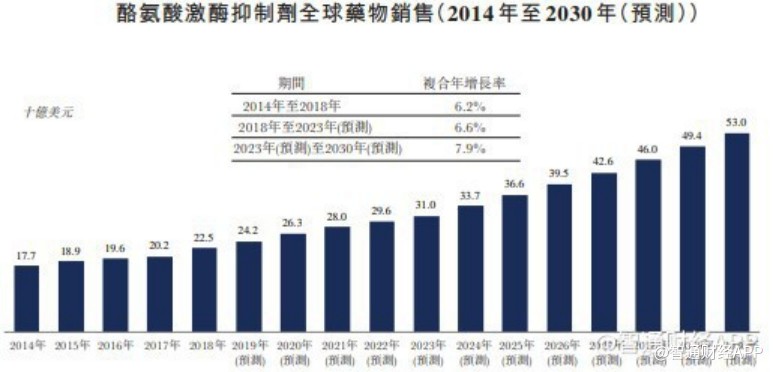
值得注意的是,目前国内关于CML治疗药物的可及性较差。国内CML治疗的药物选择较西方发达国家更少,目前真正上市的只有伊马替尼、尼洛替尼和达沙替尼。而其它二代TKI如博舒替尼,以及首款三代TKI帕纳替尼,现均未在中国上市。尤其是对于耐药或疗效欠佳或进展期的CML患者,三代TKI应该是“刚需”,但国内目前尚缺乏该类药物。
也就是说,若成功在国内获批上市,奥瑞巴替尼将成为国内首款上市的第三代BCR-ABL抑制剂,市场独占性优势明显。
由于其可以有效克服一代、二代BCR-ABL抑制剂的耐药缺陷,奥瑞巴替尼一旦上市,势必能够满足国内CML治疗市场庞大且迫切的未满足需求,迅速抢占国内CML治疗的百亿市场份额,为亚盛医药带来丰厚的利润。
随着奥瑞巴替尼正式进入上市倒计时,相关商业化进程也紧锣密鼓地开始进行。如今公司已在生产端建立了可靠的质量管理体系,打通了奥瑞巴替尼顺利商业化的通路。
去年10月末,亚盛医药顺利获得由广东省药品监督管理局颁发的奥瑞巴替尼药品上市许可人(MAH)《药品生产许可证》(B证),而这也是广东省颁发的第一个原创化药1类新药的MAH《药品生产许可证》。
取得该证意味着亚盛医药的质量管理体系的建立和对于未来上市药物生产的监督和管理的良好开端,为奥瑞巴替尼的上市申请与商业化生产打下坚实的基础。
此外,在2020年12月,公司负责商业化的核心高管正式就职,开始组建在血液肿瘤领域具有丰富经验的市场、销售团队。同时,亚盛医药在产业化方面也在快速推进,位于苏州在建的全球总部、研发中心及产业基地已完成结构封顶,或将在年内启用。
当亚盛医药陆续做好奥瑞巴替尼商业化准备的同时,作为公司核心技术储备,细胞凋亡管线的研发也有全面的进展。
细胞凋亡管线研发进入新阶段 积极探索外延机遇
智通财经APP了解到,2020年亚盛医药的研发投入达到5.65亿元。在强有力的研发投入背后,公司的管线研发进程正在全面、稳步推进。
凭借在药物结构设计及创新药物研发领域的实力,亚盛医药现已构建包括8个进入临床阶段、4个处于临床前阶段的小分子在研新药的丰富管线。报告期内,亚盛医药在全球拥有110项授权专利及450余项专利申请,其中约90项专利已在海外授权。

截至目前,公司在中国、美国及澳大利亚有超过40项I期或II期临床试验正在进行中。其中最引发业界和是市场关注的莫过于公司细胞凋亡管线研发的进度。
2020年亚盛医药在细胞凋亡领域取得了显著的研发进展,向投资者展现了自身较高的投资潜力。
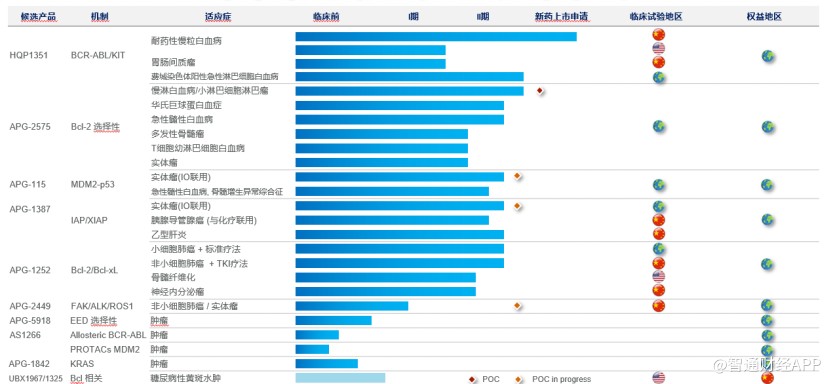
以亚盛医药APG-2575为例,APG-2575作为一款新型口服 Bcl-2选择性抑制剂,其主要作用于白血病、淋巴瘤、多发性骨髓瘤等疾病。在2020年突发公共卫生事件的大环境下,APG-2575研发却实现逆势加速。
据智通财经APP了解,自去年3月以来,APG-2575已获得美国、中国及澳大利亚的多项Ib/II期临床试验许可,正在全球同步推进多个血液肿瘤适应症的临床开发。并且,作为全球层面继venetoclax之后罕有的进入临床开发阶段的Bcl-2选择性抑制剂,APG-2575的临床潜力还获得了FDA的认可。
今年1月29日,亚盛医药宣布,美国FDA授予公司Bcl-2抑制剂APG-2575孤儿药资格认定,用于治疗滤泡性淋巴瘤(FL)。这是APG-2575继华氏巨球蛋白血症(WM)、慢性淋巴细胞白血病(CLL)、多发性骨髓瘤(MM)和急性髓系白血病(AML)适应症之后,获得的第五项FDA授予的孤儿药资格认定。
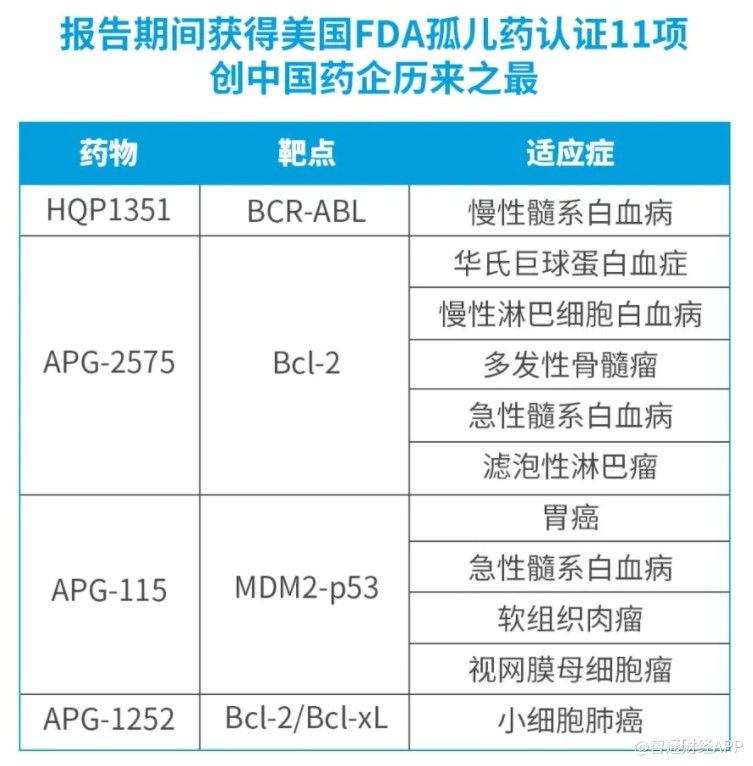
此外,截至今年3月31日,亚盛医药共有包括APG-2575、HQP1351、APG-1252及APG-115四个在研新药,共获得美国FDA授予的11项孤儿药资格以及1项审评快速通道资格,创下了中国药企历来之最,充分展现了公司的全球化创新与开发实力。
获得孤儿药认定后,将有助于亚盛医药在美国的后续研发及商业化开展等方面享受一定的政策支持,包括享有临床试验费用税收减免、免除NDA申请费用、获得研发资助等,特别是批准上市后可获得美国市场7年独占权。
今年以来,亚盛医药除了稳步推进细胞凋亡管线的国际研发,还进行了多项国际合作,积极探索外延机遇。
报告期内,公司与国家血液系统疾病临床医学研究中心达成战略合作,加码血液肿瘤领域的研究及临床开发。此外,公司通过与密歇根大学合作,开始涉足备受行业关注的PROTACs领域的研发,临床前候选药物取得新突破。去年12月,亚盛医药全球战略伙伴UNITY抗衰老领域药物UBX1325顺利进入临床,公司因此获得开发的里程碑付款。
同时,公司还积极与生物技术及医药公司建立全球合作关系。去年6月以来,亚盛医药相继与阿斯利康血液研发卓越中心Acerta制药、默沙东(MSD)达成全球临床研究合作,探索多个疾病领域的联合治疗。
其中,亚盛医药与默沙东(MRK.US)合作进行MDM2-p53抑制剂APG-115与默沙东的PD-1单抗KEYTRUDA®(帕博利珠单抗)的联合治疗的临床研究。
在此前的临床前研究表明,APG-115可促进T细胞促炎细胞因子的产生,增强CD4+ T细胞的活化,提高PD-L1在多种肿瘤细胞中的表达。APG-115联合PD-1抑制剂使用后的抗肿瘤活性在多项肿瘤模型中明显增强。可见APG-115体现出的良好的治疗特性。而目前全球针对MDM2-p53靶点尚未有上市药物,市场稀缺性叠加良好治疗特性,正是默沙东选择亚盛医药的重要原因。
由此可见,跨国药企选择与亚盛医药进行联合用药基础的搭建,说明了国际生物制药同行对亚盛医药细胞凋亡管线临床产品的充分认可。
除了国际业界,亚盛医药同样获得了资本市场的认可。2020年亚盛医药相继获纳入恒生综合指数、恒生香港上市生物科技指数和恒生医疗保健指数。并在去年12月获正式纳入港股通,投资风向标由此显现。
综上所述,伴随着奥瑞巴替尼上市在即,细胞凋亡管线全球研究的持续推进,亚盛医药即将迎来创新研发的全面收获期,这也让市场对公司今后的估值判断有了一个更加明确的锚定点。
未来,凭借即将步入商业化的重磅品种,充满想象空间的细胞凋亡研发布局以及丰厚的研发投入支撑,亚盛医药估值增长定将迈向新台阶,企业飞轮将持续加速转动。



 扫码下载智通APP
扫码下载智通APP