抗癌新药头对头挑战赛,中国新药获胜,这是如何做到的?
以下文章来源于一节生姜 ,作者一节生姜。
2021 年 4 月 28 日,百济神州(06060)宣布 BTK 抑制剂泽布替尼(百悦泽® )在一项头对头全球 3 期临床试验的中期分析中取得疗效(主要终点)和安全性(次要终点)的积极结果,表明泽布替尼为患者带来了更高的疗效与安全性。
这项临床试验,对比的是伊布替尼,治疗的是成年复发或难治性(R/R)慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL) 患者。
直接向全球重量级药物发起挑战的泽布替尼,是个什么药?
泽布替尼和伊布替尼,都是 BTK 抑制剂。啥是 BTK 呢?在 B 细胞表面,有一个 B 细胞受体,该受体一旦被激发,细胞里的 BTK 激酶就会被激活。因此,要控制 B 细胞来源的癌细胞,BTK 就是一个药物靶点,而 BTK 抑制剂就是这样的靶向药物,目的是抑制 BTK 靶点的活性,遏制癌细胞的生长。
这两个替尼药物都是 BTK 抑制剂,但区别在于,伊布替尼是全球第一代 BTK,已经上市多年,2020 年,伊布替尼全球销售额高达 53 亿美元;而泽布替尼,是一款新型的高选择性抑制剂,研发者是中国的科学家。
2019 年 11 月 15 日,美国 FDA 批准了泽布替尼,用于复发难治性套细胞淋巴瘤的治疗。它由此成为历史上第一个完全由中国企业自主研发,得到 FDA 获批上市的抗癌新药!
不仅如此,泽布替尼也是第一个获得 FDA 特殊通道认定「四大满贯」的中国新药,先后斩获了 FDA 审评的四张「通行证」:「快速通道」、「突破性疗法认定」、「优先审评」、「加速批准」。
2020 年 6 月,泽布替尼在中国获批,包括 MCL 和 CLL 两个适应症,很快就在年底被纳入了新版医保目录,为中国老百姓带来了更亲民的价格。
而继中美之后,泽布替尼又在阿联酋、加拿大获批,还迅速在全球递交了数十个上市申请,未来可能在 40 多个国家和地区上市。
可以说,泽布替尼第一次让中国现代制药以新药的形象走向世界。
泽布替尼第一次挑战,略有遗憾
泽布替尼对伊布替尼的第一个挑战,是对华氏巨球蛋白血症(WM)的治疗,头对头 3 期临床试验的名字是 ASPEN [1]。
ASPEN 是一项随机、开放标签的国际多中心 3 期临床试验,在欧洲、澳大利亚和美国的 61 个中心开展,共有 229 例 WM 患者入组,是全球范围内迄今为止 WM 治疗的最大规模 3 期临床试验。
研究结果显示,在所有患者中,经 IRC 评估,泽布替尼治疗后有 28.4% 的患者获得了非常好的部分缓解(VGPR), 而伊布替尼治疗组只有 19.2%。
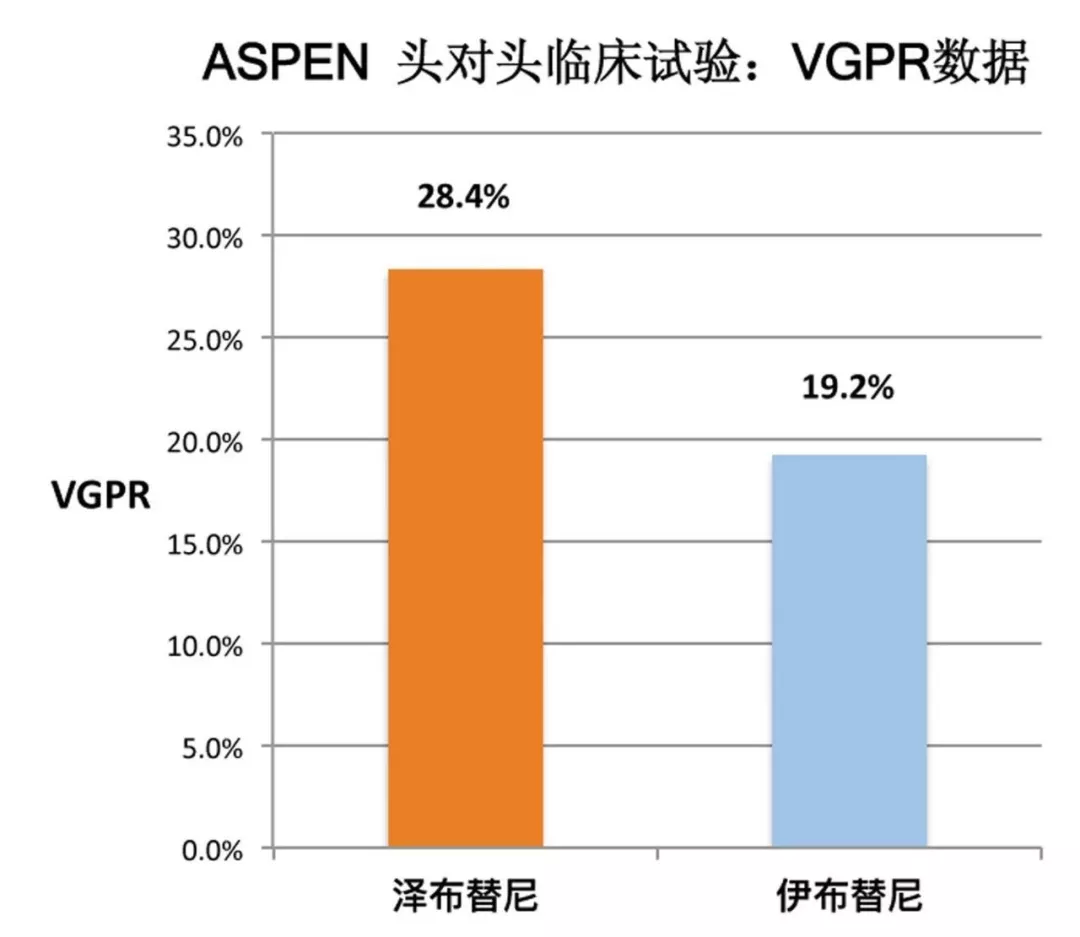
在安全性方面,泽布替尼也比伊布替尼显示出更好的优势,尤其是房颤等严重不良反应更少发生。
遗憾的是,疗效的有效性是 ASPEN 研究的主要终点,虽然泽布替尼在 VGPR 上显示出了优势,但是差异并没有达到统计学上的显著性(p = 0.0921),不能通过这个研究就完全得出「泽布替尼优于伊布替尼」的结论,只能说泽布替尼疗效不比伊布替尼差。
ASPEN 本来是一个以优效性为目的的临床试验,很遗憾没有获得完胜,其中的原因,是一代药伊布替尼确实是一个效果很不错的药,要在统计学上显示出泽布替尼的优势,需要更多的参试者样本量。而 WM 正好是一种发病率较小的罕见淋巴瘤,临床上要入组更多患者,实际上并不容易。
泽布替尼第二次挑战,目标:实现完胜
泽布替尼的研发,本来就是为了做「best in class」(同类最佳药物), 从而替代伊布替尼。泽布替尼的研发团队没有止步于第一次挑战的小遗憾。
泽布替尼向伊布替尼发起了第二个挑战,这就是目前公布中期分析结果的 ALPINE 研究。
这项研究治疗的患者是慢性淋巴细胞白血病(CLL)和小淋巴细胞淋巴瘤(SLL)。CLL 是成年人中最常见的一种白血病。数据显示,2017 年,全球范围内约有 114000 起新增病例。SLL 是一种非霍奇金淋巴瘤,主要影响免疫系统中的 B 淋巴细胞。抑制 BTK,能够有效地控制这两种疾病。
ALPINE 研究的主要终点是总缓解率(ORR),即患者治疗获得完全缓解(CR)和部分缓解(PR)的比例。ORR 越高,治疗效果越好。经研究者评估,与伊布替尼相比,泽布替尼达到 ORR 优效性,差异具有统计意义(p 值=0.0006)。
同时,该临床试验达到了安全性相关的预先设定次要终点。与伊布替尼相比,泽布替尼在患者中引起心房颤动或扑动事件的风险降低,差异具有统计意义。心房颤动或扑动是一种心律失常的表现,可导致血栓、中风、心力衰竭等其他心血管并发症。总体而言,泽布替尼安全性与先前在其临床开发项目中观察到的数据相符。
在刚公布的中期分析数据中,还有这样一句表述:「独立评审委员会(IRC)评估结果表明有更高的 ORR(p 值=0.0121),由于中期分析预设的严格双边统计边界 p 值要求<0.0099,未能达到统计意义。」
临床试验有两个不同评估标准的结果,以哪一个为准呢?如果按照 IRC 这结果,第二次挑战是不是没有达到完胜了?
并非如此!请注意:这只是中期分析评估结果,ALPINE 3 期临床试验已完成全部 652 例患者入组且正在进行中,该中期分析是在接受至少 12 个月随访的 415 例患者中开展的。随着更多的数据出来,统计学上的差异会更明显,IRC 最终评估结果也可能达到统计意义,显示出治疗的优效性。
此外,对于无进展生存(PFS),目前的数据也表明泽布替尼展现了比伊布替尼更优的趋势,按公开披露的消息,数据将在 2022 年公布。
全力投入「头对头」挑战试验,制药公司图个啥?
把一款药卖好,有两条路。
一条路是找几个表演艺术家,在各电视台轮番表演。这是一条快捷的路,当然也是一条危险的路,表演也会有演砸的时候,如果研究的投入只是广告费用,那一定会砸出非法的虚假广告。
还有一条路,就是老老实实做研究,在临床试验中比较新药与老药的治疗效果,通过获得优效性的临床试验结果,改写临床治疗的指南,打开全球新药的市场。这是一条正规的路,但却是一条艰难的路。
做头对头的直接 PK,需要花钱买伊布替尼作为对照,仅仅是购买伊布替尼药物,在一个病人身上一年可能就要花掉 10 万美金,两项试验加起来有 600 多人,其中有 300 多患者需要服用伊布替尼,尤其是这类疾病中,患者用药可能长达 3-4 年,所以光是对照药物的费用,就需要花费好几亿美金。
泽布替尼既然已经在中国现代制药史上斩获数个「第一次」,似乎已经有了很多的光环了,为什么还要选择一条艰难的道路,砸下数亿美金去做「头对头」的挑战呢?
因为这是一个国际规则!
在全球市场上,按照规则,对于一个尚无有效治疗药物的疾病,临床试验可以使用安慰剂作为对照,如果显示出有效性,就可以成为标准治疗方案。
而一但有了标准的治疗方案,后续药物开展临床试验的对照组,就需要用标准治疗。尤其是已经有同类一代药物的情况下,新药需要在头对头的比较中,挑战成功,才能成为新的标准治疗方案。
这样一个挑战赛的机制,即可以源源不断地给患者带来有确切疗效的新药,也能把疗效不佳的老药淘汰。
遗憾的是,这虽然是一个国际规则,但之前并不是国内常见的做法。
更常见的是仅仅为了显示出治疗效果,不进行「头对头」临床试验,在测试一款新药的时候,临床试验对照组只是使用安慰剂。在这样的临床试验中,入组对照组的患者等于失去了接受标准治疗的机会,在医学伦理上,是一种对参试者的伤害。同时,新药的研究等于只是原地踏步,不能进步。
如今,国内的临床研究正在逐步与国际接轨,也是近年来由于对新药研究的真正投入,才有了真正的现代新药,也才有能力按照国际规则参加国际竞争,走向世界。
优胜了伊布替尼,泽布替尼也可能成为后来者想挑战和替代的目标,也许在将来有一天,也会被另外一个药物所替代。
但这并不重要。重要的是,在它被替代之前,泽布替尼已经能够延长很多人的生命,这就是科学家为什么要研究更优的药物的原因和出发点。
这就是国际规则。




 扫码下载智通APP
扫码下载智通APP