中国双抗新药竞争格局:全员布局,谁将胜出?
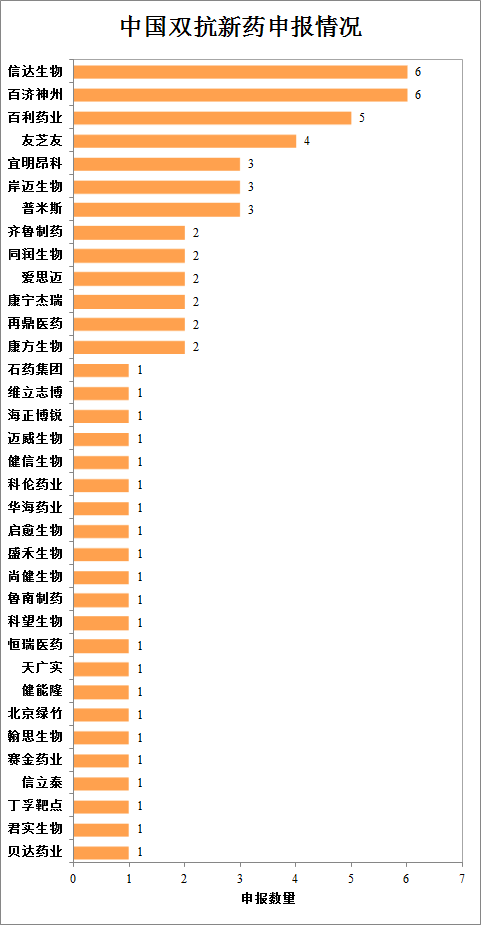
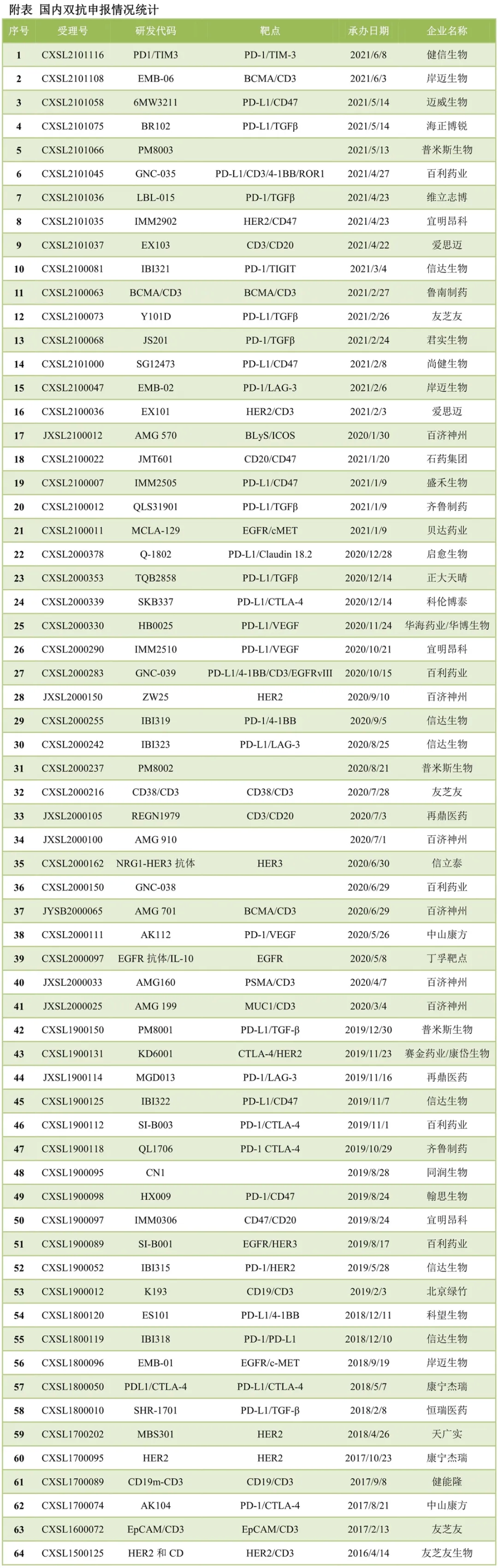
截至发稿日,国内双抗药物申报累计达到64款,涉及35家药企。信达生物(01801)与百济神州(06160)申报数量均为6款,百济神州全部为安进合作引进产品,信达生物自主研发2款、韩美引进1款、礼来(LLY.US)引进3款。自主研发方面,百利药业申报5款为最多,包括2个双抗和3个四抗,友芝友申报4款,宜明昂科申报3款,加上授权给盛禾的则为4款。普米斯生物和岸迈生物均为3款,康方生物(09926)、康宁杰瑞(09966)、齐鲁制药(包括1款复方抗体)、同润生物、爱思迈、再鼎医药(ZLAB.US,09688)(均为引进)均申报2款。
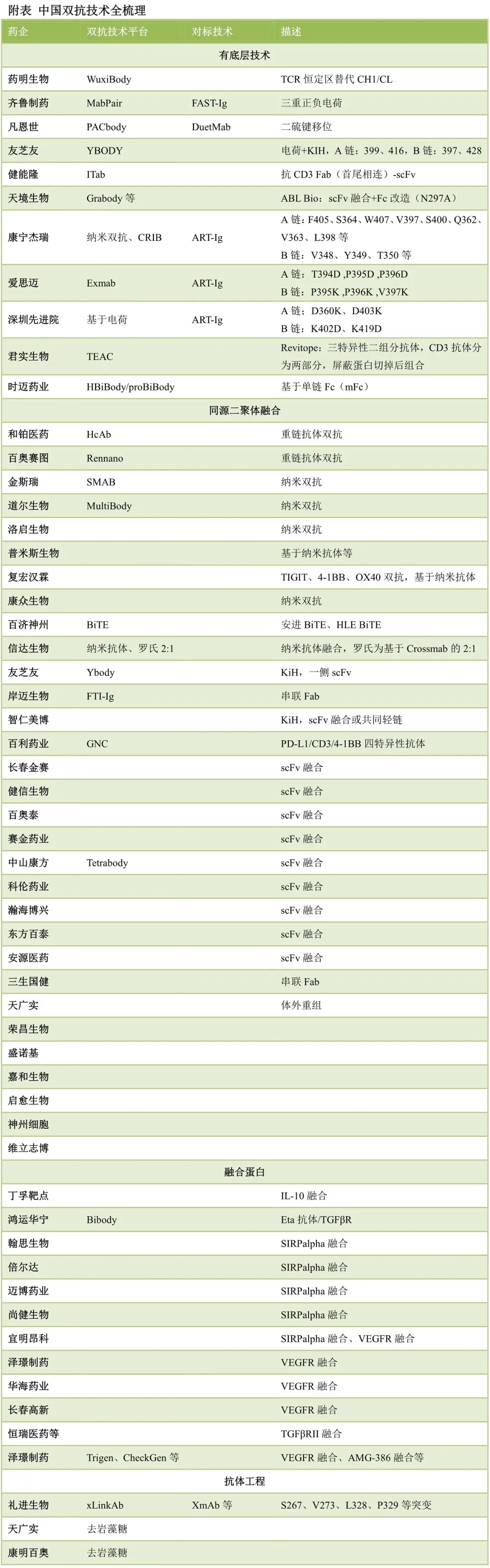
CDMO企业方面,药明生物有基于TCR构建的WuXiBody双抗技术,金斯瑞有基于纳米抗体的SMAB双抗技术,并申请了3款CD47双抗专利。拥有重链抗体小鼠的和铂医药和百奥赛图都都构建了双抗技术平台。
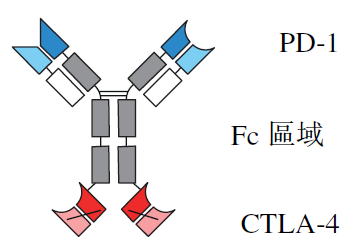
从临床进展上看,康方生物PD-1/CTLA-4双抗已经在多个适应症早期临床中表现出突破性的疗效和安全性,目前处于晚期临床阶段,PD-1/VEGF双抗早期临床也表现出优异数据,CD73抗体经过初步临床验证,PD-1/CD73双抗已经在路上。康宁杰瑞HER2双表位双抗早期临床表现出媲美新一代HER2 ADC的数据,且比ZW25的早期临床数据更好。上个月,阿斯利康发表文章阐释了PD-1/CTLA-4双抗更有效、更安全的深层机制。
总结
国内药企对于双抗的热情很高,几乎所有生物医药企业均有所布局。双抗的竞争设计底层技术、构建形式(价态、融合方式、scFv/Fab/纳米抗体的选择等)、靶点组合(双TAA、CD3双抗、免疫双抗)等。在技术和靶点组合百花齐放的局面之下,康方生物AK104等双抗药物等逐步脱颖而出,未来将迎来越来越多的临床突破。
本文选编自“医药笔记”,智通财经编辑:张金亮。



 扫码下载智通APP
扫码下载智通APP