新股前瞻丨累计亏损超10亿,禾木生物携全套神经介入器械二次闯关港交所
因6个月内未能通过聆讯,导致招股书失效,再次递表的情况屡见不鲜,禾木生物工程有限公司(以下简称“禾木生物”)便是这样的例子。
智通财经APP了解到,2月25日,禾木生物二次闯关港交所,摩根士丹利、中金公司、瑞信为其联席保荐人。据悉,该公司曾于2021年7月30日递表港交所。
招股书显示,禾木生物成立于2017年,是一家专注于血管介入领域创新解决方案的平台企业。
目前,禾木生物已在中国及广泛亚太地区建立全套针对神经血管及外周疾病的创新介入医疗器械。其中,神经介入医疗器械的全面产品组合涵盖所有缺血性脑卒中、出血性脑卒中及神经通路领域。
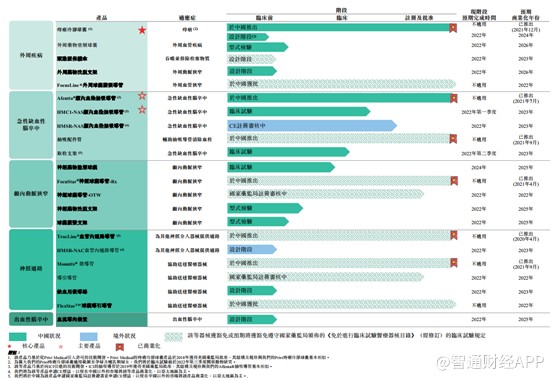
目前,公司旗下有6款产品已经取得商业化,2款已经获得国家药监局或其地方对口单位批准的产品,14款处于开发阶段的产品。
近几年18A生物医药企业颇受资本市场喜爱,多数公司在成立不久便获得不少的融资,并且估值并不低。据招股书显示,自成立以来,禾木生物也获得了4轮融资,共募得约1.38亿美元的金额,并且投资方不乏高瓴资本、礼来、君联资本、3H Health、LAV、OrbiMed等医药投资大拿。在最后一轮C轮融资后,禾木生物的估值也达到了4.56亿美元。
六款产品商业化,累计亏损亦超10亿
尽管公司已经有多款产品开始商业化,但公司目前依旧处于亏损状态。
招股书显示,公司从2020年4月开始创收,2020年和2021年前九个月,禾木生物的营业收入283.9万元和843.4万元。2020年4月,公司的TracLine®血管内通路导管开始销售,2021年4月、7月和9月,公司的FocuStar®神经球囊导管、Afentta®抽吸导管,以及抽吸配件管和Mountix®微导管开始逐步销售销售,这些产品均为神经介入医疗器械。2021年12月,公司首款外周介入医疗器械Privi痔疮冷却球囊实现商业化。这也意味着2022年公司业绩还会有所提升。
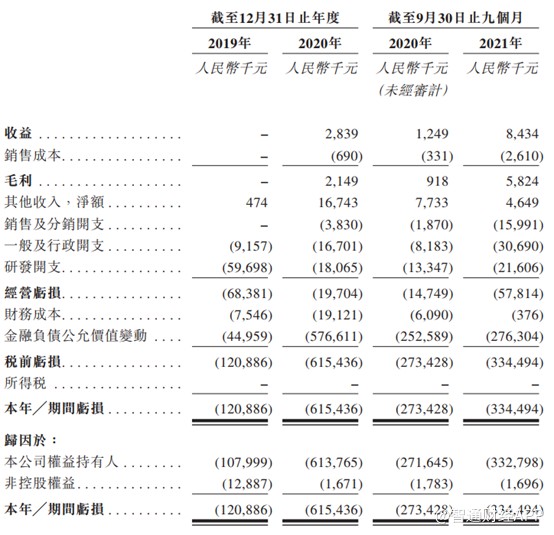
净利润方面,业绩期内公司持续亏损,分别亏损1.21亿元,6.15亿元和3.34亿元,累计亏损已经超10亿。不过这些亏损主要来自于金融负债公允价值变动。众所周知,在港股市场上很多企业都有类似的情况,这些公允价值是由A轮B轮等一些列融资产生的,上市后便不会有此类金融负债变动损失。
扣除金融负债公允价值变动,公司依然亏损,业绩期内公司实现亏损0.76亿元、0.39亿元和0.58亿元。
毛利率方面,公司的的毛利率从截至2020年9月30日止九个月的73.5%,降低至2021年同期的69.1%,主要因为公司的产能扩张,导致生产人员数量增加。

研发投入方面,公司的研发开支分别为5969.8万元、1806.5万元和2160.6万元。禾木生物称,其拥有强大的知识产权组合。截至最后实际可行日期,该公司拥有九项已发布专利及17项待批专利申请。
值得注意的是,该公司于往绩记录期拥有五名客户,其中2020年及2021年前三季度来自最大客户所得收益为260万元及830万元,占比分别为92.4%及98.6%。根据招股书显示,公司拥有五家分销商及103家子分销商,分销公司的六种商业化产品,目前公司的分销商合计覆盖中国24个省市的306家医院,但是从收入结构来看,只有一家经销商有实质性的销售结果,其他四家经销商出货量不大。
管线丰富细致,全面抢注神经介入领域
招股书显示,禾木生物已经商业化的产品包括TracLine血管内通路导管、FocuStar神经球囊导管-Rx、Afentta颅内血栓抽吸导管、抽吸配件管、Mountix®微导管以及Privi痔疮冷却球囊。
尽管公司已有多款产品进行商业化,但市场竞争也相对激烈,并且公司多款产品更偏向于“小零配件”,因此市场渗透率低,推广难度也相对较大。
具体来看,TracLine血管内通路导管主要用于神经介入手术,通常与特定神经介入器械配合使用,如取栓支架、球囊导管、弹簧圈及血流导向装置等。
中国颅内动脉狭窄神经介入手术数量并不少,根据弗若斯特沙利文,2020年中国颅内动脉狭窄神经介入手术的数量为2.73万宗,至2025年有望增长至10.99万宗,2020年至2025年复合年增长率高达32.1%。虽然手术量很多,但市场规模也并不是很大,2020年中国神经介入通路器械市场规模仅4亿元,至2025年也才16亿元。
不仅如此,2020年,中间导管(包括公司的TracLine® 血管内通路导管)的渗透率为仅0.3%,至2025年也仅为1.1%。由此可见,作为辅助类产品,市场推广压力并不小。
除此之外,该类产品市场竞争压力也十分激烈,截至最后实际可行日期,国家药监局已批准27种中间导管,其中9种为国际制造商,18种为国内制造商。如此看来,倘若要放量,该类产品自然也避免不了集采的风险。
再看公司的血栓抽吸导管,该产品主要疗急性缺血性脑卒中的抽吸导管。2017年公司获ICI授予开发主要产品Afentta®颅内血栓抽吸导管及HMC1-NAS 颅内血栓抽吸导管的技术及专利。其主要Afentta®颅内血栓抽吸导管(内径为0.071英寸或更小)于2021年5月获得国家药监局批准,并于2021年7月在中国进行商业化。
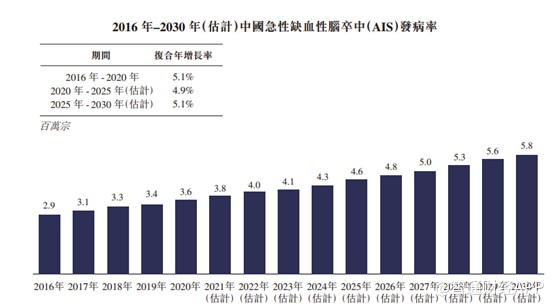
脑卒中主要有两种类型:缺血性脑卒中及出血性脑卒中。急性缺血性脑卒中(AIS)是指通过大脑动脉的血流被栓块(即大量增厚的血液)阻塞时发生的疾病。AIS占中国脑卒中事件的69.6%至70.8%。随着人口增长及老龄化,AIS新症持续增加。
静脉溶栓(IVT)及机械性血栓清除(MT)是治疗颅内血管疾病的主要方法。若干研究已证实,ADAPT(即直接抽吸首次再通技术)为实现良好的血管造影和临床结果的简单快速的方法。
在美国,单是ADAPT手术就占2019年AIS MT手术总数的41.3%。单独使用SR技术及合并使用抽吸法与SR技术分别占同年AIS MT手术的29.3%及29.3%。相反,ADAPT在中国的发展还处于起步阶段。自2017年至2019年,中国进行的ADAPT手术数量仅为取栓支架术的十一分之一。
根据弗若斯特沙利文,中国的急性缺血性脑卒中的发病率从2016年的290万人增加至 2020年的360万人,并预期进一步增加至2025年的460万人及2030年的580万人。随着更多的医生接受有关使用ADAPT技术的培训并累积丰富的临床经验,预计ADAPT疗法在中国将迅速发展,血栓抽吸导管作为急性缺血性脑卒中的治疗方法具有巨大的发展潜力。
截至最后实际可行日期,国家药监局已批准5家厂商的4种抽吸导管的注册证书。
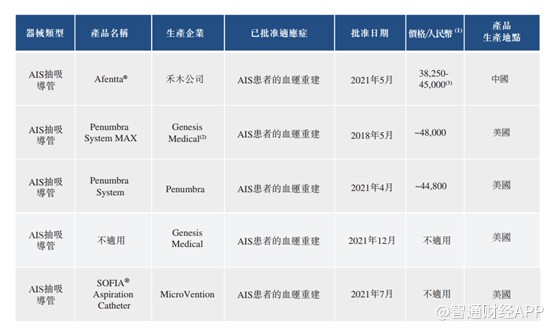
另外4种抽吸导管正在进行临床试验,1种正在接受国家药监局的注册审核。
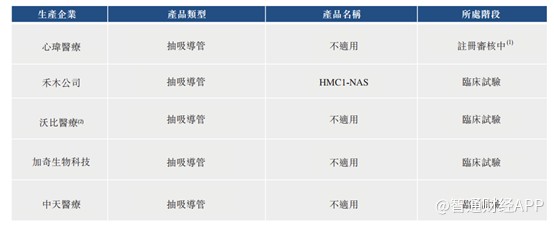
根据弗若斯特沙利文,截至最后实际可行日期,Afentta®颅内血栓抽吸导管是国内首个获得中国药监局批准并于中国进行商业化的治疗急性缺血性脑卒中的抽吸导管,并且其包含国家药监局批准的最大远程内径型号。
另外,公司的HMC1-NAS颅内血栓抽吸导管也处于临床阶段,根据弗若斯特沙利文,公司的088型号的HMC1-NAS颅内血栓抽吸导管一旦获得批准,可能拥有市场上抽吸导管中全球最大的远程内径,预期在2022年第一季度完成该项临床试验。
除此之外,公司内部开发的HMSR-NAS颅内血栓抽吸导管现正进行CE注册审核,其若干功能与Afentta®及HMC1-NAS颅内抽吸导管不同,预计在2023年将该产品商业化。
在强调医疗器械国产替代的大环境下,禾木生物的竞争形势或较为明朗。
上文提到,治疗急性缺血性脑卒中患者颅内血管中的闭塞性血栓的另一手段是取栓支架。作为机械性血栓清除术的器械,取栓支架可单独使用,或于抽吸术不成功的情况下用作ADAPT疗法的替代物。
由此来看,在治疗急性缺血性脑卒中方面,禾木生物的产品管线十分丰富且细致,公司预期将在2022年第二季度完成取栓支架临床试验,2023年在获得国家药监局批准后,进行商业化。
取栓支架为用于急性缺血性脑卒中的血管内治疗机械性血栓清除术的主要器械,取栓支架的疗效已于全球范围内被广泛的综合循证临床应用证明。中国取栓支架市场相对处于发展的早期阶段,自2015年以来,中国的临床应用迅速增长。
根据弗若斯特沙利文,截至最后实际可行日期,国家药监局共批准16种取栓支架,其中有9种由国际公司制造,7种由国内公司制造。此外,截至最后实际可行日期,另有3个国内制造的取栓支架,包括禾木生物的取栓支架,目前正在接受临床试验或处于上市准备阶段。
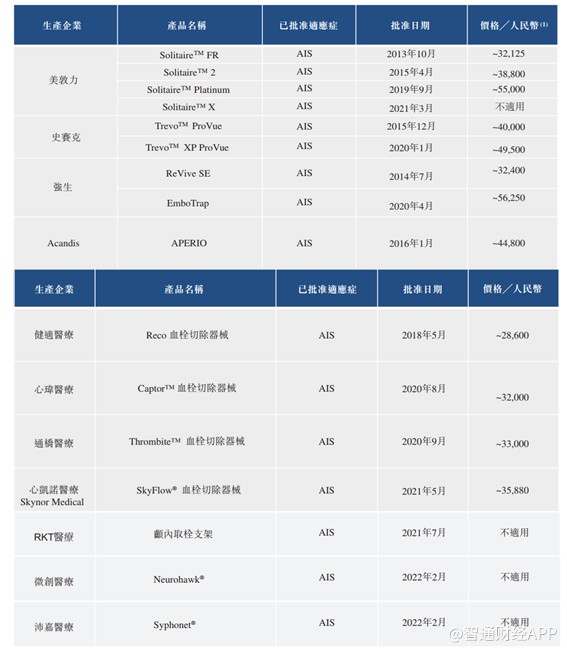
由此可见,禾木生物的取栓支架上市后或将面临较为激烈的竞争压力。不过好在公司已有其他相辅相成的产品上市,若这些产品推广顺利,公司的取栓支架上市也能通过这些已上市产品的渠道放量。
综合来看,尽管公司已经有多款产品进行商业化,但由于商业化体系并不完备,因此商业化进展尚处于初期,与最早在2018年便实现产品获批的竞品公司相比,产品市场化进度慢显而易见,因此短期得到可观的业绩兑现获较难实现。另外,公司产品管线主要押注于神经介入方面,尽管市场空间不小,但竞争也相对激烈,因此公司能否从中脱颖而出,尚待考究。




 扫码下载智通APP
扫码下载智通APP