创新药挑起业绩大梁,和黄医药(00013)却离收支平衡点越来越远
与国内大多仿制起家的药企不同, 和黄医药(00013)从创立初期就一直明确地坚持只做中国原创新药,但从其此前的商业模式来看,和黄医药作为一家处于商业化阶段的创新性生物制药公司,其主要有两大块业务,一是研发创新平台,用于研发新型抗癌药物;二是商业平台,经营成熟且有盈利的处方药及消费保健品业务。
从往绩来看,2017-2019年,和黄医药的营收收入分别为2.41亿美元、2.14亿美元和2.04亿美元,其中依靠处方药和保健品销售收入的商业平台则几乎贡献了80%的业绩。但随后受两票制等政策影响,其商业平台的处方药业务受到冲击,创新药业务才开始在其整体财务中崭露头角。
而经过疫情3年的增长,目前创新药板块已成为和黄医药的核心增长板块,只是随着全球临床试验的开展,公司研发投入只增不减,“收支平衡”压力越来越大。这在和黄医药发布的2022年财报中体现明显。
创新药挑大梁,收支平衡压力增大
在宣布了与武田制药达成的11亿美元Licence out大单后的一个月,和黄医药披露了其2022年年度财务业绩。
智通财经APP了解到,2022年和黄医药总营收达到4.26亿美元,创新药板块中,公司肿瘤/免疫综合业务收入达1.64亿美元,同比增长37%。不考虑合作方分成情况下,公司三款已商业化的肿瘤创新药的实际销售额则达到1.67亿美元。其中,苏泰达®自2022年1月起获纳入国家医保药品目录后,收入增长178%至3230万美元。
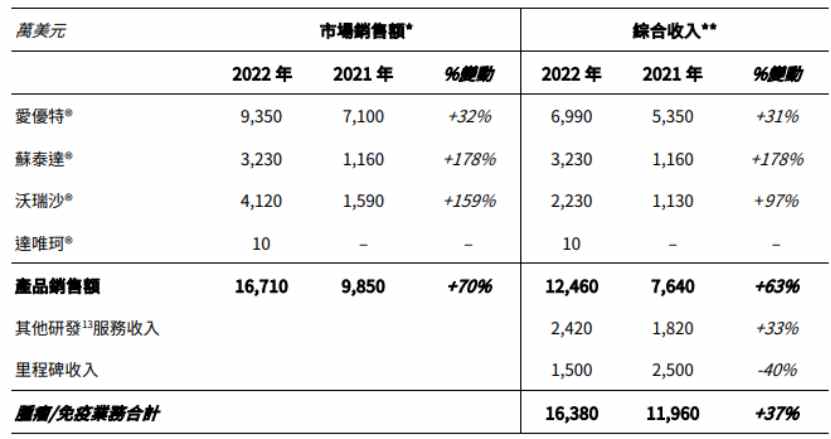
另一方面,得益于处方药销售额增加,2022年公司其他业务综合收入增长达到2.63亿美元,同比增长11%。此外,公司还有来自阿斯利康及礼来管理中国开发活动的其他研发服务收入2420万美元以及由阿斯利康就启动SAFFRON研究而支付的里程碑付款1500万美元。
此外,和黄医药还在年报中公布了其2023年的收入指引在4.5-5.5亿美元区间,同比2022年翻了2.5倍。
虽然和黄医药在收入端增长喜人,但在费用端的支出也同样惊人。
据智通财经APP了解,截至2022年12月31日止年度净开支为7.87亿美元,而2021年为5.51亿美元。其中,商业化支出为3.11亿美元,其中大部分是通过公司有盈利的其他业务旗下公司销售第三方处方药产品的成本,以及商业化创新药所需的成本开支;相较之下,公司同期的研发开支达到3.87亿美元,增长主要是因为扩展公司的创新肿瘤候选药物的研发。
从创新药板块的最新研发进展来看,公司目前拥有十余款在研或临床前的抗癌类创新药物,另外拥有四款已在中国获批上市的创新药物:爱优特®(呋喹替尼胶囊)、苏泰达®(索凡替尼胶囊)、沃瑞沙®(赛沃替尼片)和达唯珂®(他泽司他)。此外,其还有超过45项临床研究正在全球范围内进行,其中至少15项注册性临床在未来三年计划递交NDA。
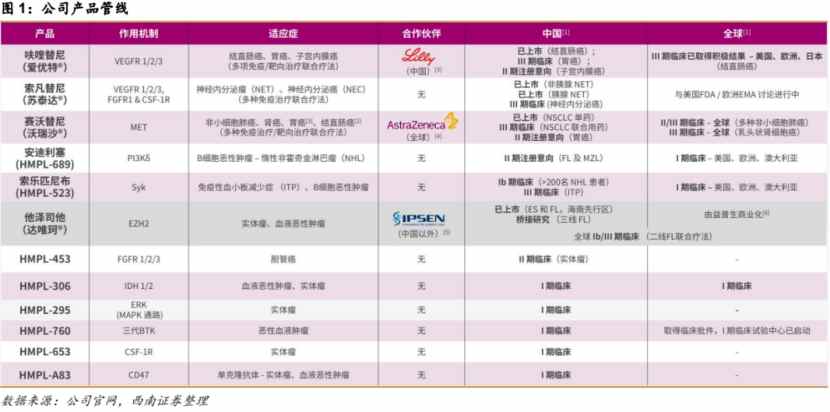
以核心产品呋喹替尼为例,和黄医药首个国际多中心临床试验——呋喹替尼治疗难治性转移性结直肠癌2的FRESCO-2 III期研究,结果于ESMO3发表,达到总生存期的主要终点,死亡风险降低34%;目前公司已开始向美国FDA滚动提交呋喹替尼用于治疗难治性结直肠癌的新药上市申请;此外,呋喹替尼的FRUTIGA中国III期研究取得具有显著统计学意义的PFS获益,新适应症补充申请正在准备中。
综合来看,在和黄医药的核心管线中,由呋喹替尼领衔,正有6款产品开展15项注册研究。
不过,在创新管线大量布局研究也存在一定弊端,除了上文提到的在公司费用端增加压力外,公司的现金流也面临一定压力。
数据显示,截至2022年12月31日,和黄医药年度净亏损为3.61亿美元,同比扩大85.38%。与此同时,公司烧钱速度加快,当期现金及现金等价物和短期投资合计为6.31亿美元,而去年同期为10.12亿美元。2022年,和黄医药不包括融资活动的调整后的(非GAAP49)净现金流为负2.98亿美元。
也就是说,在加大创新药投入后,和黄医药收支平衡的压力正在逐渐变大。
一边烧钱,一边战略收缩?
去年11月,和黄医药发布公告,宣布调整企业战略。其中提到将会:优先考虑其后期注册研究及通过监管机构的批准这些药物上市;某些早期研究不会再被优先考虑用于内部开发,某些其他专案会考虑外部商业机会等。
简言之,公司将尽快推进后期管线上市,而前期研究项目或面临战略调整。
结合最新发布的财报来看,和黄医药正在开发六种处于早期临床试验阶段的抗肿瘤候选药物,其中包括IDH1/241双重抑制剂HMPL-306、BTK42抑制剂HMPL-760、FGFR 1/2/3口服抑制剂HMPL-453、CSF-1R抑制剂HMPL-653以及一款CD47单抗HMPL-A83。在“顾后不顾前”的策略以及加速烧钱的背景下,以上6款药物研发或面临公司的战略调整。
但也正是因此,目前上市的索凡替尼、呋喹替尼和赛沃替尼将成为和黄医药后续重要的业绩承压点。在国内市场竞争逐渐白热化,产品利润受到集采和医保谈判影响的背景下,核心产品出海情况也就顺理成章成为市场评判和黄医药估值的重要锚点。
但在去年,公司首款产品索凡替尼出海失利,FDA以美国患者数据不够多,数据不足以支持为由驳回了索凡替尼的获批,要求和黄补做国际多中心临床试验。正是因此,多家机构在和黄披露中报后纷纷下调其目标价。
出海上市进度上,呋喹替尼进度更快。此前呋喹替尼国际多中心临床试验已达到预设终点。而在去年12 月 19 日,和黄医药也宣布向美国 FDA 滚动提交呋喹替尼用于治疗难治性转移性结直肠癌的新药上市申请。
目前看来,和黄医药已经商业化的三款产品的趋势都不错,但是目前的销售体量,确实不足以支撑公司有所管线齐头并进,因此“出海发育”迫在眉睫。
只是从目前FDA的审评审批程序来看,美国药监部门在审评数据时,第一道门槛是‘代表性’,即申请人提供的临床试验数据是否与当前美国病人群组情况相吻合,因此国际多中心的临床试验难以避免;其次,临床试验的设计和最终结果非常重要,在已有同类产品竞争的情况下,该药必须证明在有效性、安全性以及病人获益率上具有明显优势,对照组试验应首选当前美国的疾病标准疗法,有必要时应开展头对头试验。
对于已失利一次的索凡替尼而言,补做国际多中心临床意味着上市日期通常至少会有半年以上的推迟。而还在申请途中的呋喹替尼之后能否成功也还是未知数。而和黄医药后续的估值走势或许还是要看其之后核心产品的出海进展。



 扫码下载智通APP
扫码下载智通APP