普吉华一线NSCLC新增适应症国内获批 基石药业(02616)打开长期上升空间
在持续的研发投入下,港股创新药企基石药业(02616)的新药研发再度传来好消息。
6月27日,基石药业发布公告称,其同类首创精准治疗药物高选择性RET抑制剂普吉华®(普拉替尼胶囊)用于RET基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗已获中国国家药品监督管理局(NMPA)批准,这也是基石药业在大中华区获批的第十一项新药上市申请。
适应症扩容,普吉华®销售额有望提升
普吉华®(普拉替尼胶囊)是一种口服的强效高选择性RET抑制剂。此前,普吉华®在中国大陆已经获批两个适应症,包括用于治疗二线的非小细胞肺癌(NSCLC)以及一线甲状腺髓样癌(MTC),如今用于治疗一线RET NSCLC适应症的获批,表明普吉华®在中国大陆已获得三项适应症。这一适应症将是普拉替尼的关键适应症,获批后有望大幅提升普拉替尼的销售额。
据了解,RET属于原癌基因,其编码的RET蛋白是一种跨膜蛋白,该蛋白属于受体酪氨酸激酶家族。RET融合突变与多种癌症的发生发展相关,最常见的肿瘤谱为非小细胞肺癌(2%)和甲状腺癌(10%-20%)。
相关研究数据表明,我国是NSCLC患者大国,且NSCLC患者分子变异谱不同于西方人群,主要体现在腺癌,少见罕见基因包括RET、MET、ROS1、NTRK、NRG1/2等。其中,RET基因融合在NSCLC中的发生率约为1.4%-2.5%。根据《2022年CSCO非小细胞肺癌诊疗指南》,我国NSCLC新发人数约70万人,即使仅2%的发病率,每年新发RET阳性NSCLC患者约1.5万人。包括NSCLC、甲状腺癌等多种肿瘤类型在内,我国每年确诊的RET突变肿瘤患者数量约7万人。
此次普吉华®用于治疗一线RET融合阳性NSCLC的适应症获批后,其适用人群较之前显著扩大,加上普吉华®在中国香港和中国台湾也已获批上市,其市场销售额有望大幅度提升。根据西南证券测算,普吉华®在2023-2025年的销售额将分别有望达到4亿元、6亿元和 8.6亿元。
值得一提的是, RET基因发生点突变和融合突变会引发包括NSCLC、乳头状TC、结直肠癌、卵巢癌、胰腺癌、胸膜间皮瘤、胃癌、胆管癌在内的多种实体瘤。而此前普拉替尼全球I/II期ARROW临床研究的更新数据表明普吉华®在RET融合阳性的多种实体瘤中均具有良好的治疗效果,这为普吉华®应用于泛瘤种提供了初步数据支持。伴随着更多适应症的开发,其诊疗价值和商业潜力也进一步凸显。
研发实力雄厚,具备先发优势+疗效优、安全性佳
适应症广以外,目前,国内RET抑制剂竞争格局也十分宽裕。截至目前,国内仅两款RET抑制剂获批上市,分别为基石药业的普拉替尼和礼来的塞普替尼。其中,普拉替尼是中国首款上市的精准靶向RET抑制剂,比塞普替尼上市时间快1年半,其他在研的产品多数处于I/II期临床试验。与其他竞品相比基石药业的普拉替尼先发优势明显,并且已覆盖三种适应症。上市时间早且多适应症覆盖,基石药业有望享受更多的市场红利。
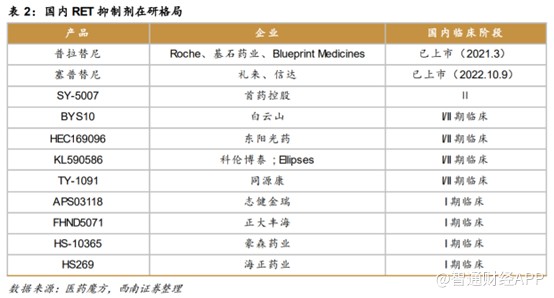
除了研发进度快以及适应症多之外,基石药业的普吉华®所表现出来的临床研究数据也十分优异。
据了解,此次普吉华®的扩展适应症在国内获批是基于ARROW研究,该研究是一项全球性I/II期临床研究,截至2022年3月4日,共纳入来自10个中国研究中心的68例晚期RET融合养性NSCLC患者。
从该研究的临床涉及来看,入组的受试者包括37例既往接受过铂类化疗的和31例未接受过系统性治疗的患者,受试者接受普吉华®起始剂量为400 mg(每日一次)的治疗,肿瘤缓解通过盲态独立中心评审(BICR)采用《实体肿瘤反应评估标准》(RECIST)1.1版进行评估。
有效性方面,不管既往是否接受过治疗,普吉华®在中国RET融合阳性晚期NSCLC患者中均取得了持久的临床获益,并且初治患者的缓解率更高。其中,既往接受过铂类化疗的患者确认的客观缓解率(ORR) 为66.7%,包括1例完全缓解和21例部分缓解;疾病控制率(DCR)为93.9%。未接受过系统性治疗的患者确认的ORR为83.3%, 包括2例完全缓解和23例部分缓解;DCR为86.7%。
安全性也是新药临床试验中的关注重点之一,药物安全性将影响未来临床实践的可行性和患者用药依从性。安全性数据方面,普吉华®耐受性良好,在中国患者中整体安全可控,且没有发现新的安全信号。
优异的临床数据充分展现了普吉华®在治疗RET融合阳性晚期NSCLC患者中的优势,为晚期NSCLC以及既往接受过铂类化疗的患者用药提供了新的思路和选择。
国际知名肿瘤学期刊《Cancer》也于2023年6月在线发表了ARROW研究中普吉华®治疗RET融合阳性NSCLC中国患者的疗效和安全性更新结果;这也是继在2022年12月的欧洲肿瘤内科学会亚洲峰会(ESMO Asia)上公布数据之后,普吉华®在RET融合阳性NSCLC中国患者群体中的临床数据再次获得国际学术界的认可。
值得注意的是,包括普吉华®在内,基石药业已上市四款药物均在国际学术舞台上有过精彩的表现。其中择捷美®两项注册性III期临床研究分别在欧洲肿瘤内科学会胃肠道肿瘤大会(ESMO GI 2023)上进行口头报告以及在Nature子刊Nature Cancer上发表;拓舒沃®多项研究成果先后登陆美国临床肿瘤学会(ASCO)年会和欧洲血液学协会(EHA)年会;泰吉华®在ASCO年会上公布两项重磅研究数据。在获得全球业界高度认可的同时,也进一步验证了基石药业的强大研发实力,充分体现公司的价值。
走向患者,不断提升产品覆盖面
产品获批仅仅是一切的开端,“走向患者”是基石药业发展的核心,公司的商业化道路,也是围绕着这个理念。公司从患者的需求、药物可及性、患者支付能力、精准靶点检测、医生与患者的认可度等多重维度构建商业化路径。
好的产品,需要强大的商业化团队才能让更多的患者受益。在药物可及性方面,基石药业通过自建销售团队和战略合作两种方式增加药物可及性。自建团队方面,目前公司的商业销售团队覆盖超过700家医院,200家DTP药房,所覆盖的医院占精准治疗药物相关市场的约70%-80%。对外合作方面,公司与国药控股进行战略合作,扩大普吉华®(普拉替尼)及泰吉华®(阿伐替尼)于医院及药店的分销范围。
解决买得到的问题后,还要解决患者用得起的问题。为减轻患者的负担,在可支付性方面,基石药业持续致力于将自己的产品纳入患者援助、商业保险、医保等报销途径,提升产品的可及性与可负担性。自上市以来,普吉华®可及性和可负担性均得到巨大提升,现已在200家医院和DTP药房列名,并被超过130个城市纳入商业保险项目,患者支付能力显著增强。
不仅如此,普吉华®以其出色的临床优势被纳入9项国家性指南,近期发布的《中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南2023版》把普吉华®用于IV期RET融合NSCLC后线治疗上调为I级推荐,并新增普吉华®用于IV期RET融合NSCLC一线治疗的用药推荐;上市两年来,中国真实世界临床使用经验已经累计达数千例,获得医生以及患者的广泛认可。
此外,基石药业已经实现了普吉华®在对应准入的头部医院实现了80%的检测率,并通过与国家病理控制中心合作提高准确率。
随着商业运营体系的持续完善与策略的不断优化,基石药业将持续致力于提升产品的可及性与可负担性,覆盖更多的患者。在公司完善的销售体系下,公司已上市的4款创新药物也正快速放量,公司的收入也在2022年实现质的飞跃,达到3.94亿元,同比大增142%。
结语
凭借着出色的临床试验结果,普吉华®一线RET NSCLC扩展适应症在中国的获批,不仅为RET融合阳性的局部晚期或转移性NSCLC中国患者提供更好的治疗手段,基石药业也将从中受益,今年公司的收入有望得到大幅提升。
作为中国增长迅速的创新药企业,基石药业一直以来都在不断增加研发投入,致力于为全球癌症患者提供更多治疗机会。展望未来,公司将进一步充分挖掘在研管线的潜力,随着研发管线适应症的不断扩大和核心产品商业化的推进,为更多的患者提供更好的治疗手段。在提高优质创新药物可及性的同时,也将为公司本身带来更高的市场价值和投资价值。
目前基石药业市场估值仍处于历史底部,被大幅低估。近几个月,公司首席执行官杨建新持续回购公司股份,彰显对公司后续成长性的信心。



 扫码下载智通APP
扫码下载智通APP