4+7城市带量采购政策落地 仿制药行业或迎来变革
本文来自光大海外,作者为李君周、吴佳青,本文观点不代表智通财经观点。
摘要
事件:11月15日上午,上海阳光医药采购网挂出《国家组织药品集中采购试点方案》公布第一批带量采购目录31个品种,带量采购将在4个直辖市+7个省会城市试点。该文件对申报方案、申报品种和数量做出具体要求。
4+7城市带量采购政策落地
网传已久的带量采购政策正式出台,此前关于政策暂停等争议平息,该文件1)明确了带量采购的具体31个品种(与流传的采购方案相比,该采购目录中头孢唑林钠/氯化钠注射剂、紫杉醇注射剂被剔除);2)确定了采购总量约为16万袋/片/支,采购总量与此前版本相比有所下降并没有提及按照试点地区年度用药量的60~70%进行采购;3)明确了药品采购的时间周期,采购以结果执行日起12个月为一个采购周期,申报材料、议价谈判确认时间为今年12月6日,快于此前预期,我们预计政策明年开始落地实施。
中标采取预中选和拟中选制
根据文件公布的细则,中标流程采取预中选和拟中选制,最终只有1家企业中标,即1)企业先报价,该品种选定一家企业预中选;2)有 3 家报价的品种,预中标满足条件即为拟中选品种;3)有 2 家报价的品种,需要满足低价/销量大/中标地区多、降幅双方达成一致后,为拟中选品种;4) 1 家企业申报条件的,直接获得预中选资格,降幅协商决定,为拟中选品种。我们认为在保证质量的前提下,仿制药行业将会迎来行业洗牌,带量采购将推动行业集中度提升。
短期对港股上市公司影响有限,长期来看推动仿制药企业集中度提升
港股上市公司中,中国生物制药纳入且通过一致性评价的品种为5个,石药集团纳入品种为3个,联邦制药为2个,虽然降价幅度尚未确定,但短期来看该11个城市的药品带量采购对上市公司的收入和盈利的影响十分有限。长期来看,仿制药行业降价是大势所趋。在保证质量的前提下,带量采购试点甚至全国范围的推广将有利于仿制药行业集中度提升,推动仿制药企业利润率向欧美等发达国家靠拢。
投资策略
集中采购政策靴子落地,仿制药板块将迎来行业集中度提升,板块或存在一定压力。在市场波动较大的情况下,我们关注安全边际较高相关标的。1)景气度较高的器械龙头公司:威高股份、微创医疗。2)港股创新药龙头公司:中国生物制药、石药集团。3)二线业绩稳健标的:中国中药、联邦制药。
风险提示:带量采购品种降价幅度超过预期、政策落地的不确定性、带量采购全国联动的不确定性、试点范围和试点品种的扩大具有不确定、医保对接不确定性。
正文
1、4+7城市带量采购试点政策靴子落地
1.1、政策解读
11月15日,上海阳光医药采购网挂出《国家组织药品集中采购试点方案》公布第一批带量采购目录31个品种。第一批带量采购清单此次带量采购首先将在11个城市进行试点,包括北京、上海、天津、重庆4个直辖市和7个省会城市,即广州、深圳、沈阳、大连、西安、成都、厦门。此前,国家医疗保障局主导下在上海召开的试点联合采购会议,与会议中流传的采购方案相比,目前公布的采购目录中头孢唑林钠/氯化钠注射剂、紫杉醇注射剂被剔除(从33个品种减少到31个),同时相关品种采购量均呈现了不同程度的减少。
本次集中采购以结果执行日起12个月为一个采购周期,申报材料、议价谈判确认时间为今年12月6日,4+7城市带量采购试点政策预计明年开始落地实施。 我们认为2 家以上通过一致性评价的品种价格竞争激烈,之后的带量采购降价幅度将更为明显。仅一家通过的品种,目前来看竞争相对温和。
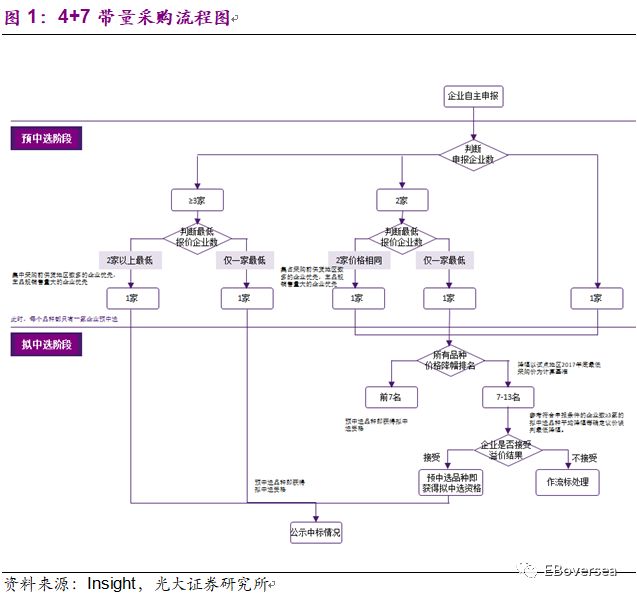
中选品种确定:
1)按价格确定:同品种符合申报条件的企业数≥2家的,最低报价只有1家企业的,该企业的申报品种获得预中选资格。价格次低者作为中选候选企业,在中选企业无法保障供应时备选。仅有1家企业符合申报条件的,直接获得预中选资格。2)同品种符合申报条件的企业数≥2家的,当出现最低报价≥2家企业的情况,按以下规则及顺序确定1家企业获得预中选资格。
获得预中选资格的企业及申报品种,统一进入议价谈判确认程序。1)符合申报条件的企业数≥3家的品种:预中选品种申报价格符合本次报价的有关要求,经双方确认后,获得拟中选资格。2)符合申报条件的企业数≤2家的品种:①预中选品种申报价格降幅排名前列的(不多于7家),经双方确认后获得拟中选资格;②其余预中选品种:联采办参考符合申报条件的企业数≥3家的拟中选品种平均降幅等确定议价谈判最低降幅。申报价格符合降幅要求且达成一致意见的,即可获得拟中选资格。若不参加或不接受议价谈判的,该品种作流标处理,且将影响该企业在试点地区所涉药品的集中采购。(降幅以试点地区2017年底最低采购价为计算基准)。
1.2、具体品种梳理
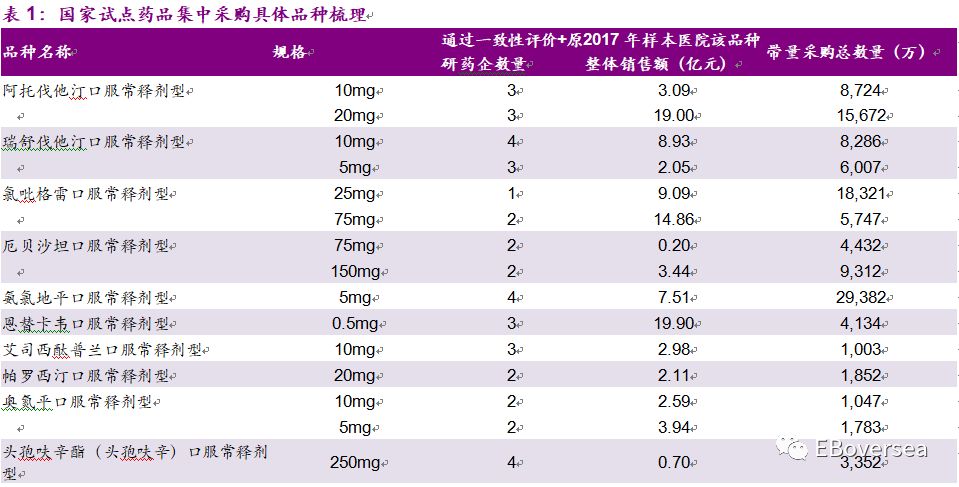
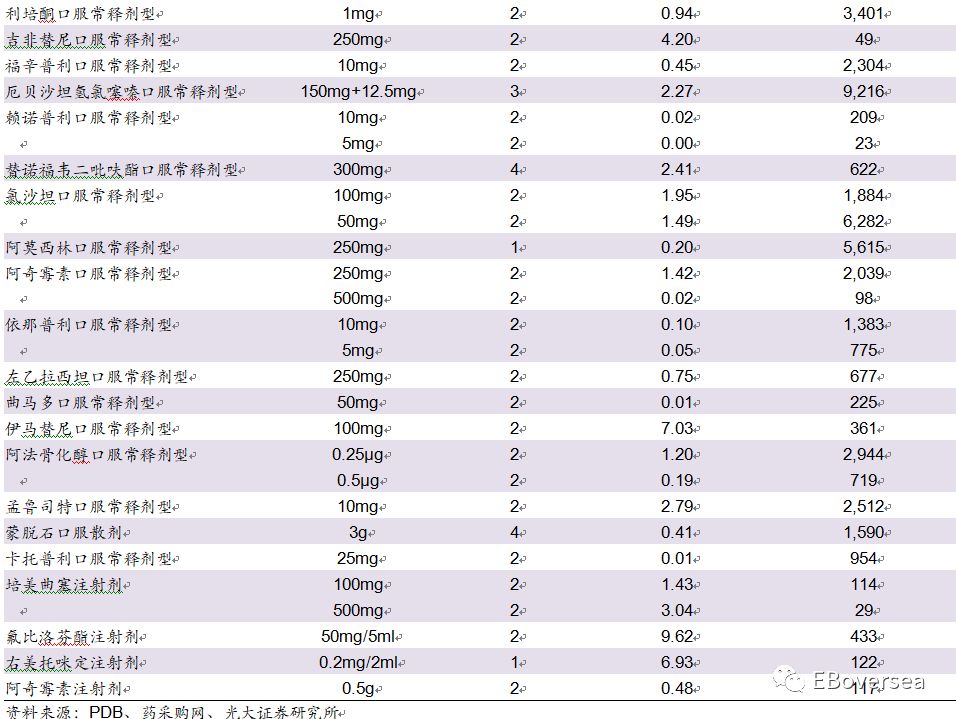
根据PDB样本医院数据计算,此次带量采购涉及到的31个品种的样本医院2017年销售额约为150亿元人民币,约占样本医院整体市场6.7%。药品带量采购总量与网传版本相比有所下降,如氯吡格雷口服常释剂型采购量最大2.41亿片(此前版本2.54亿片)、阿托伐他汀口服常释剂型采购量2.44亿片(此前版本2.56亿片)等。
从竞争格局看,28个品规通过一致性评价和原研药企的总数达到2家,5个品规达到3家,5个品规达到4家,3个品规仅1家。总体来看,目前的竞争格局仍然较为温和,外资原研药企预计受到影响较大,未来随着更多药企通过一致性评价,竞争格局将变得更为激烈。
2、政策将推动仿制药企业集中度提升
此次带量采购目录中,中国生物制药纳入且通过一致性评价的品种包括厄贝沙坦氢氯噻嗪片、瑞舒伐他汀钙片、恩替卡韦分散片、替诺福韦二吡呋酯片、氟比洛芬酯注射液,这5个品种17年销售额为59亿元人民币,其中预计带量采购4+7个城市销售额约为10亿元人民币。目前参与带量采购的竞价带来的降价幅度未知,因此对于销售额和利润影响尚不能进行测算。但是总体来看,带量采购对于今年和明年的盈利影响非常有限,公司可以通过减少销售费用、提升院外渠道销售等方式尽量减少影响。
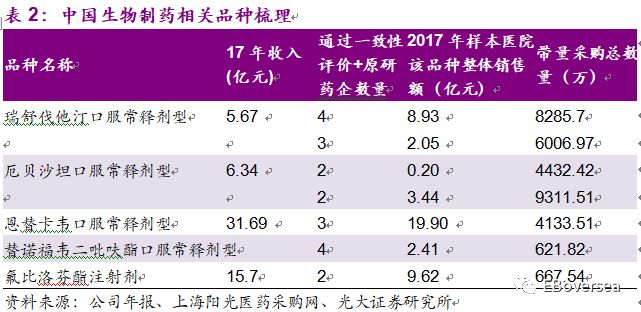
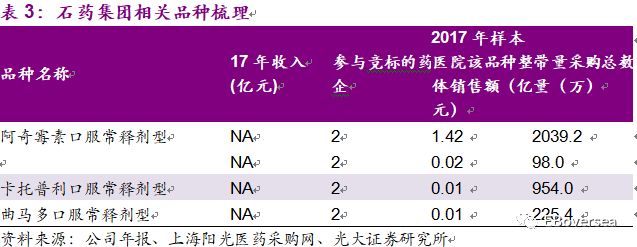
此次带量采购目录中,石药集团纳入且通过一致性评价的品种包括卡托普利片、曲马多片、阿奇霉素片。这3个品种的销售额非常小,公司尚未披露这几个药品17年销售收入,占公司2017年收入的比例可以忽略不计。
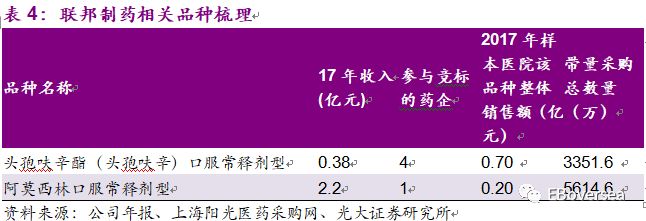
此次带量采购目录中,联邦制药纳入且通过一致性评价的品种主要包括阿莫西林胶囊、头孢呋辛酯片。头孢呋辛酯片250mg规格和阿莫西林250mg规格17年销售收入约为2.58亿元,约占公司17年收入的4%。总体来说对公司的收入的盈利影响较小。
3、行业要闻
3.1、政策
《国家基本药物目录(2018年版)》。11月1日, 《国家基本药物目录(2018年版)》正式实施。此次调整共调入药品187种、调出22种,总品种数量达到685种,其中西药417种、中成药268种,多种药品的“入选”引人关注。其中12种抗癌药新增入基药目录,使抗肿瘤药物的种类达到38种,其中不乏小分子靶向药等创新药物
广东出台改革完善仿制药供应保障及使用政策实施方。11月11日,广东省人民政府办公厅印发广东省改革完善仿制药供应保障及使用政策实施方案的通知(以下简称实施方案)。该方案旨在促进广东省仿制药研发,提升仿制药质量疗效,提高药品供应保障能力,推动医药产业实现高质量发展。
保证疫苗安全 《疫苗管理法(征求意见稿)》公开征求意见。11月11日,国家市场监督管理总局发布“《中华人民共和国疫苗管理法(征求意见稿)》公开征求意见的公告”(以下简称《意见稿》),向公众征集反馈意见,意见反馈截止时间为2018年11月25日。
《药品出口销售证明管理规定》发布。11月13日,国家药品监督管理局发布《药品出口销售证明管理规定》(以下称《规定》)。按照国际惯例,在药品进出口贸易中,应进口国药品监督管理部门要求,出口国药品监管部门为本国药品出口型企业出具产品资信证明。《规定》的发布不仅规范了相关证明的办理,还为我国药品出口型企业提供便利和服务。《规定》在原国家药品监督管理局2001年发布的《关于印发<出具“药品销售证明书”若干管理规定>的通知》的基础上作出了较大调整与修改,并使用了世界卫生组织推荐证明文书的格式,以更好地与国际通行做法接轨。
3.2、行业
普利制药注射用更昔洛韦钠在美国上市
11月11日,海南普利制药股份有限公司(以下简称“普利制药”或“公司”)近日收到美国食品药品监督管理局(FDA)签发的注射用更昔洛韦钠ANDA批准通知(ANDA 号:204204)。注射用更昔洛韦钠是2018年公司继左乙拉西坦和阿奇霉素后在美获批的第三个产品,出口进程稳步推进,后续随着在研及申报产品的丰富,产品获批有望进一步加速。国内市场方面,普利的注射用更昔洛韦钠已于今年5月获批上市,凭借欧美市场认证,后续有望参照阿奇霉素快速获得一致性评价认证。
信达生物提交阿达木单抗生物类似药上市申请
信达生物11月12日宣布,国家药品监督管理局(NMPA)已受理其在研药物阿达木单抗注射液生物类似药(研发代号:IBI303)的新药上市申请(NDA)。这是继4月份提交信迪利单抗(sintilimab)上市申请并被纳入优先审评后,信达生物第二个获得NMPA受理的新药上市申请。信达生物在研的17个单克隆抗体新药品种已经有两个进入上市申请阶段。
桂林三金PD-L1靶向创新药获批临床
11月12日,桂林三金发布公告称,公司已经收到国家药监局核准签发的全人源抗PD-L1抗体注射液的药物临床试验批件,将尽快按照上述药物临床批件要求开展全人源抗PD-L1抗体注射液的临床试验研究。未来,桂林三金将继续加快推进宝船生物和白帆生物的其他在研品种的研发,进一步深化生物制药战略布局。
恒瑞2类新药获批百亿非甾体抗炎抗风湿药市场将迎新品
11月13日,恒瑞医药发布公告,称近日收到了国家药监局核准签发的《临床试验通知书》,并将于近期开展美洛昔康混悬注射液的I期临床试验。据悉,美洛昔康混悬注射液是一种静脉注射用非甾体类抗炎药,拟用于术后中重度疼痛的治疗。目前,国内外尚无该产品获批上市。
10年来首个一线治疗新药卫材乐卫玛中国上市
日本药企卫材(Eisai)中国子公司卫材(中国)药业有限公司近日宣布,在中国市场推出靶向抗癌药Lenvima(中文品牌名:乐卫玛,通用名:甲磺酸仑伐替尼)。今年3月,卫材与默沙东达成全球战略合作,共同开发和商业化Lenvima。在中国市场,卫材(中国)公司将与默沙东(中国)公司将联合为Lenvima提供支持。在中国,Lenvima于2018年9月初获批,作为一种单药疗法,用于治疗既往未接受过全身系统治疗的不可切除的肝细胞癌(HCC)患者。中国是全世界肝癌患者最多的国家,此次Lenvima上市,标志着中国近10年来一线治疗不可切除性肝细胞癌(HCC)的首个新系统疗法。
3.3、海外观察
礼来镇痛管线突破:5-HT1F激动剂申请FDA审批
日前,礼来宣布已经向美国FDA提交了首创偏头痛药物Lasmiditan的新药申请(NDA),用于治疗伴或不伴先兆症状的偏头痛成人患者。此次提交申请的依据主要是这款5-HT1F激动剂的后期试验数据。数据显示,患者在口服该药后,可以在两小时内迅速清除头痛症状。Lasmiditan是近20年来偏头痛药物研发的重要创新。研究显示,约有三分之一的偏头痛患者因为心脏疾病等问题无法接受曲普坦类药物的治疗,因此该药物将为约四千万患有偏头痛的美国患者提供新的治疗选择。
默沙东减毒活疫苗V920启动向FDA滚动提交上市申请
美国制药巨头默沙东(Merck & Co)近日宣布,已启动向美国食品和药物管理局(FDA)滚动提交疫苗产品V920(rVSV∆G-ZEBOV-GP,减毒活疫苗)的生物制品许可申请(BLA),该疫苗用于扎伊尔型埃博拉病毒(Ebola Zaire)的预防。此次滚动提交,是基于FDA在2016年7月授予V920的突破性药物资格。该公司预计,将在2019年完成滚动提交。
FDA授予第一款针对自杀性双相抑郁症口服药物突破性疗法认证
美国当地时间2018年11月13日,一家处在临床阶段的制药公司 NeuroRx,宣布其研发的药物NRX-101,已经获得美国FDA授予的突破性疗法认证。该药物主要用于治疗具有急性自杀意念和行为(ASIB)的严重双相抑郁症患者,这也是第一款被授予突破性疗法认证的口服速效抗抑郁药物。今年4月,FDA还为该公司正在进行的关键的2b/3期临床试验发布了一项特别协议(SPA)。NeuroRx在最近一项报告中公布了其在STABIL-B研究中取得的振奋人心的研究结果,该研究表明NRX-101的耐受性良好,没有严重的不良事件及中断副作用。
4、风险提示
带量采购品种降价幅度超过预期、政策落地的不确定性、带量采购全国联动的不确定性、试点范围和试点品种的扩大具有不确定、医保对接不确定性。




 扫码下载智通APP
扫码下载智通APP