对比美日德,从药物经济学看创新药定价逻辑的重塑
本文来自微信公众号“医心医意要健康”,作者:光大医药团队。
创新药投资的核心是临床价值
创新药高利润的经济现象来源于垄断的竞争格局,而竞争格局的关键并非在于创新的概念,而是在于实现不可替代的临床价值,以及相比现有疗法更好的解决患者需求。所以创新药投资的核心在于分辨其临床价值高低。
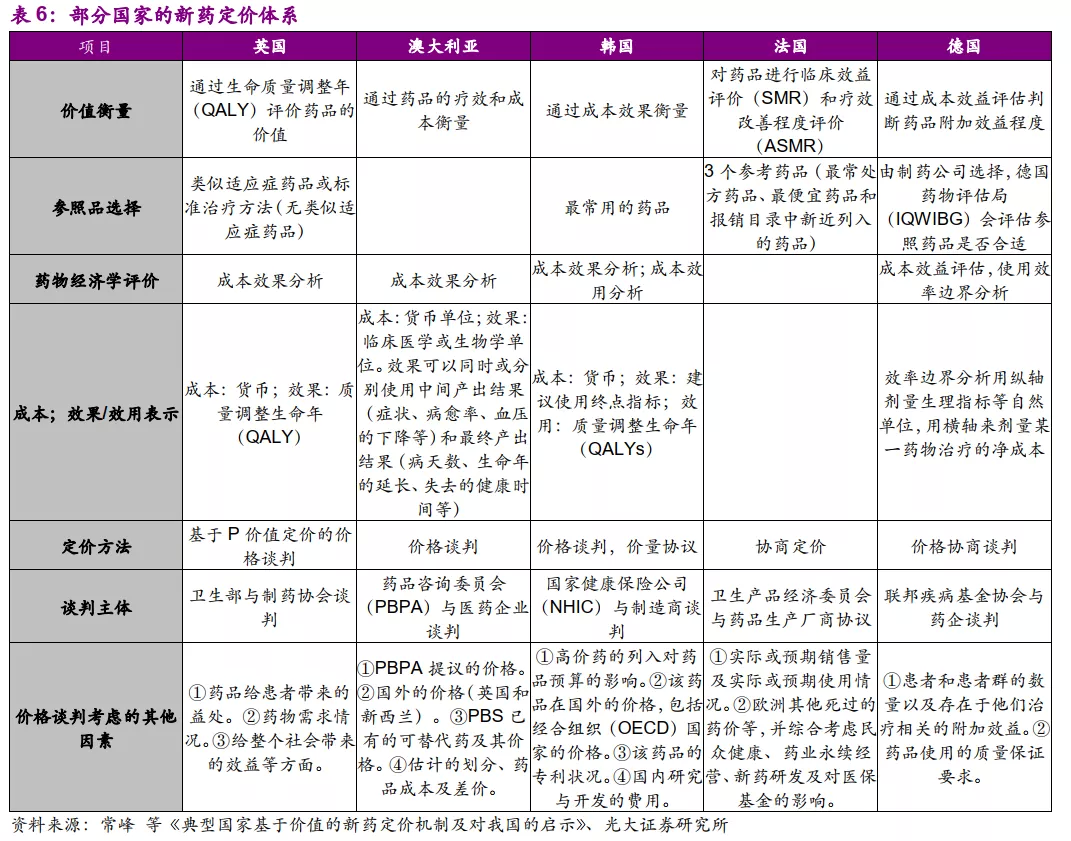
成熟市场的创新药定价模式借鉴
我们梳理了成熟市场的三种创新药定价模式,分别是:1)美国:自由定价法,由复杂的价值链条支撑高昂的药价;2)日本:比价与成本计算法,若有可比药物,则基于可比药物给予临床价值溢价;若无可比药物,则采取成本计算方法;3)德国:谈判定价法,基于额外获益进行谈判。综合来看,基于临床价值对创新药定价是较为主流的趋势。
大医保时代的创新药经济学定价,临床价值即定价筹码
我国医保谈判逐渐常态化,未来将成为创新药进入医保的主流途径。从2019年底的医保谈判结果来看,药物经济学方法已成为价格谈判理论基础之一,我们判断未来将成为主导创新药定价的核心方法论。而医保支付方式改革、DRGs等新付费方式的推进,又可能促使药物经济学引导医疗机构的用药行为。从国际主流的增量成本效果测算模型可发现,临床价值是未来创新药商业价值的基石,临床获益高的药物将拥有更多的价格谈判空间,而临床价值不突出的药物将面临激烈的价格战。
创新药定价逻辑的重塑:临床价值为王
随着创新药经济学的广泛应用,未来创新药将回归患者需求的本质,更加注重药物创造的临床价值,我们看好三类创新药投资方向:1)First/ Best-in-Class类创新药,依靠专利或技术壁垒等护城河形成长期、不可替代的临床价值;2)First-Follow,即Me-too类创新药中进度领先者,虽无法在临床价值上实现优胜,但可凭借领先竞争对手的时间窗口迅速收回相对可控的研发成本;3)创新国际化,在尽可能多的市场中将创新药临床价值变现为商业价值。
投资建议:
随着医保谈判的常态化和药物经济学在定价中的广泛应用,创新药的定价逻辑正发生深刻变革,我们认为未来创新药将回归患者的临床需求,临床价值是未来创新药定价与销售最核心的决定因素。我们看好能够做到First/Best-in-Class、First-Follow、创新国际化的高临床价值创新药。
风险分析:
创新药研发失败或不达预期的风险;谈判降价超预期的风险;销售收入不达预期的风险。
投资聚焦
研究背景
医保谈判逐渐常态化,已经成为创新药快速进入医保的主流途径。2019年医保谈判共150个品种,包括119个新增谈判药品和31个续约谈判药品,共有97个药品经谈判纳入国家基本医保乙类目录,包括70个新增谈判药品和27个续约药品,价格较医保谈判前平均降幅分别达到了60.7%和26.4%,部分品种降价温和,但巨幅降价者也不乏其例,例如3种丙肝创新药价格降幅平均在85%以上。
此次谈判中部分品种巨大的降幅引发了投资者的广泛担忧,是否未来创新药的价格在进医保时都会面临如此剧烈的降幅?什么样的创新药在价格谈判中会更有优势?为解决投资者的疑问,我们特别撰写了这篇创新药经济学深度报告,阐述创新药定价背后的经济学原理,为未来的创新药投资提供参考。
我们的创新之处
(一)创新药的投资价值并非在于创新的概念,而是在于不可替代的临床价值;
(二)参考成熟市场,梳理全球创新药的多种定价规则;
(三)深入解读医保谈判背后的药物经济学原理,并总结出创新药未来发展的核心要素:临床价值即定价筹码,是商业价值的基石;
(四)从创新药经济学定价的角度,重新审视创新药发展逻辑,提出三种有较高投资价值的路线:
First/Best-in-Class:依靠专利或技术壁垒等护城河形成长期、不可替代的临床价值;
First-Follow:即Me-too类创新药中进度领先者,虽无法在临床价值上实现优胜,但可凭借领先竞争对手的时间窗口迅速收回相对可控的研发成本;
创新国际化:在尽可能多的市场中将创新药临床价值变现为商业价值。
投资观点
随着医保谈判的常态化和药物经济学在定价中的广泛应用,创新药的定价逻辑正发生深刻变革,我们认为未来创新药将回归患者的临床需求,临床价值是未来创新药定价与销售最核心的决定因素。我们看好能够做到First/Best-in-Class、First-Follow、创新国际化的高临床价值创新药。

1、创新药投资的核心是什么?
1.1、创新药赚钱的本质:垄断的竞争格局
创新药区别于仿制药的关键在于拥有专利保护,一套完善的专利网可以为创新药企业有效阻隔后来竞争对手,维持某个药物分子甚至某个治疗领域的垄断竞争格局,以此获得较高的定价权与渗透率。以辉瑞的立普妥(阿托伐他汀)为例,在专利保护期内,该专利药是全球销售额超过百亿美金的超级“重磅炸弹”药物,支撑如此优秀销售额的因素,除了阿托伐他汀相比传统他汀类药物更加优秀的疗效之外,专利保护形成的垄断竞争格局是重要因素。但在2011年,FDA批准仿制药上市之后,原研药立普妥的销售额即迅速下滑。
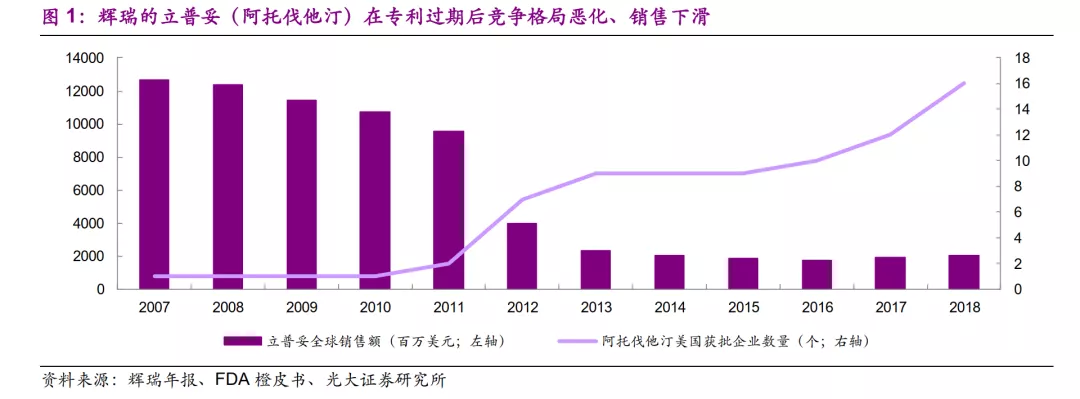
1.2、竞争格局的关键:不可替代的临床价值
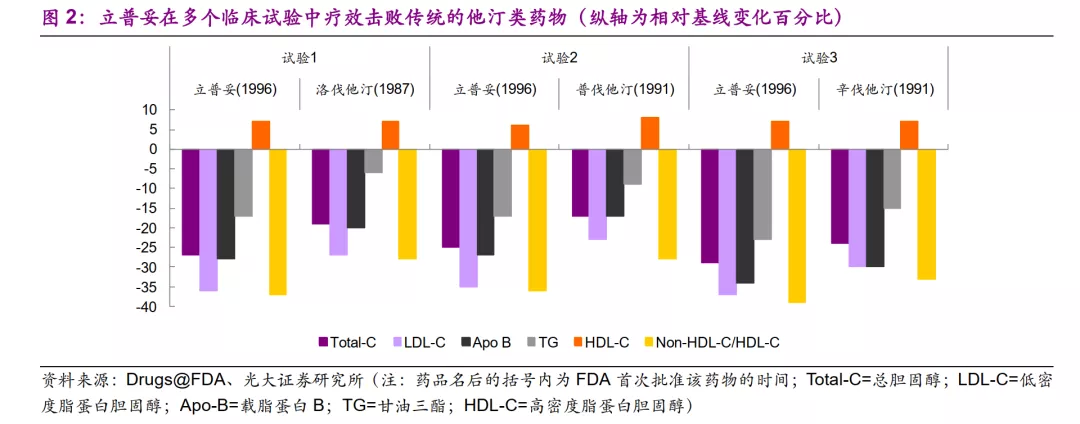
任何药物的核心竞争力必然是临床价值。以立普妥为例,该药物1996年获批上市,在多个临床试验中击败传统的他汀类药物,如洛伐他汀(1987年上市)、普伐他汀(1991年上市)、辛伐他汀(1991年上市),在降低血脂的各项终点指标上胜出,成为当时他汀类药物的Best-in-Class。立普妥的强大临床价值成为其百亿美元销售额的基石。
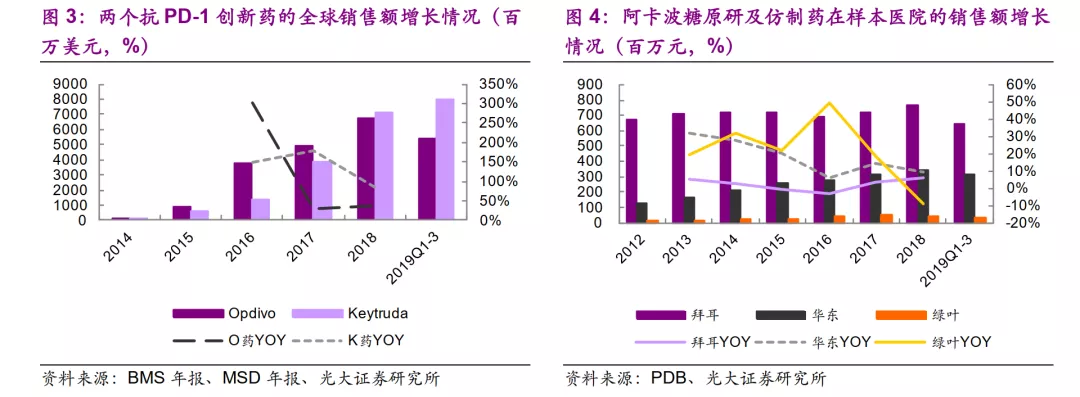
竞争格局的关键在于临床价值的优势,而非“创新药”的概念。以全球最早上市、目前销售额最高的两个2014年上市的PD-1单抗为例,尽管Opdivo以创新药的注册分类上市,且起步阶段放量快于Keytruda,但由于同为抗PD-1单抗,药理作用相近,临床效果相似,并未形成垄断型竞争格局;而Keytruda又凭借肺癌一线等大适应症的率先获批后来居上,随着其他PD-1/L1类单抗陆续上市,该类抗体药竞争格局日趋激烈。PD-1/L1类药物之所以尚未过专利期便已面临激烈的竞争格局,其原因就在于没有实现明显优于同靶点竞争对手的临床价值。
而反观阿卡波糖的国内市场,虽然已过专利期,有仿制药上市,但市场上长期维持拜耳、华东、绿叶的三分格局。其中原研厂商拜耳的销售额从2012年以来保持相对稳定,并未由于仿制药的竞争而出现断崖式下跌,而华东和绿叶的仿制药则实现多年快速增长。阿卡波糖专利过期而原研药销售额保持稳定,同时仿制药销售额迅速增长,优良的竞争格局是一个重要的原因。
2、成熟市场如何为创新药定价?
2.1、自由定价(美国):复杂的价值链条支撑高昂药价
2.1.1、巨大支出撑起全球创新药的“兵家必争之地”
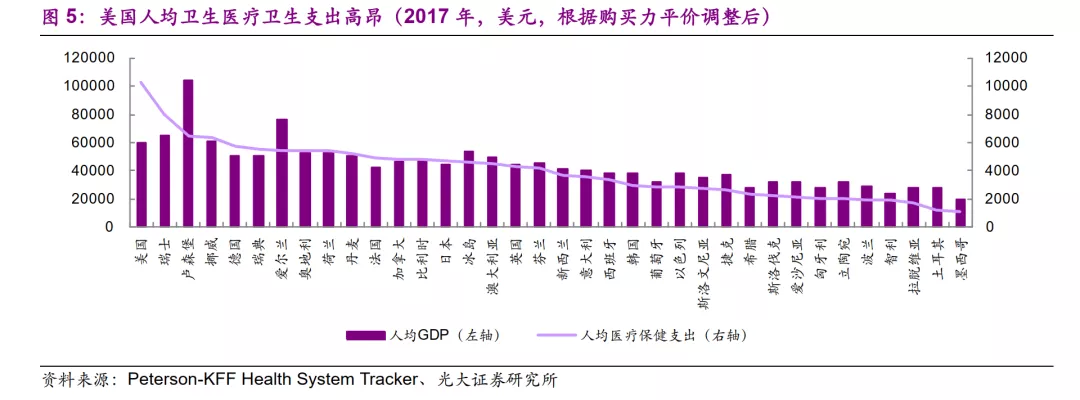
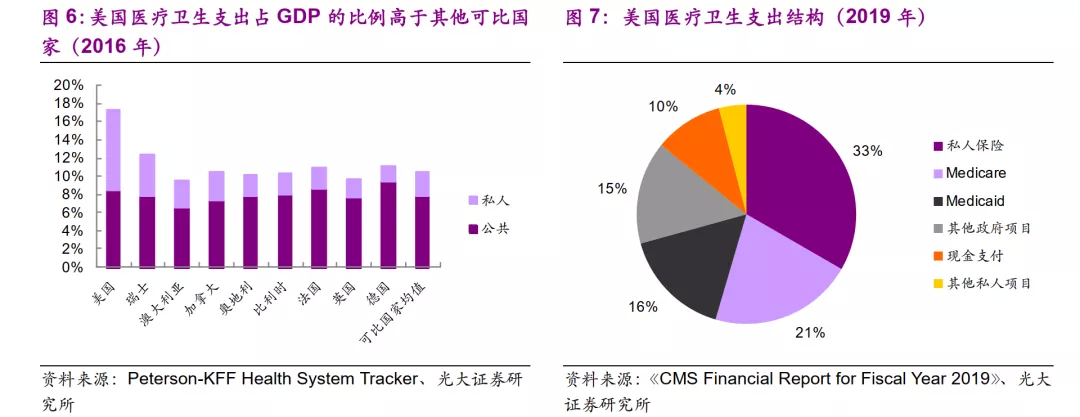
美国的医疗保健支出水平很高,2016年支出占GDP的比例已经高达17%。从支出结构上来看,美国的公共卫生支出与私人卫生支出比例相近,公共卫生支出的占比与可比国家也较为接近,但私人卫生支出占比是其他可比发达国家的2~3倍。2019年美国医疗卫生的支出结构中,份额最大的是私人保险,占比33%,政府医保计划Medicare和Medicaid分别占比21%、16%。巨大的支出总量与市场化的支出结构成为美国医药市场繁荣的基石。
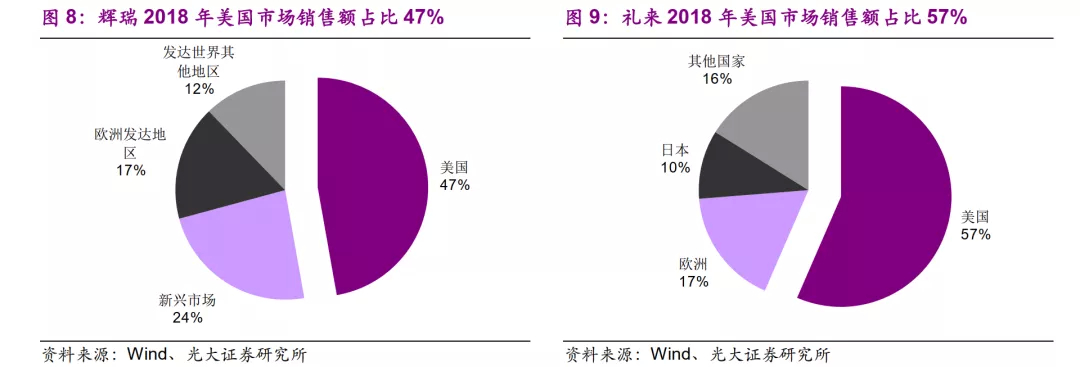
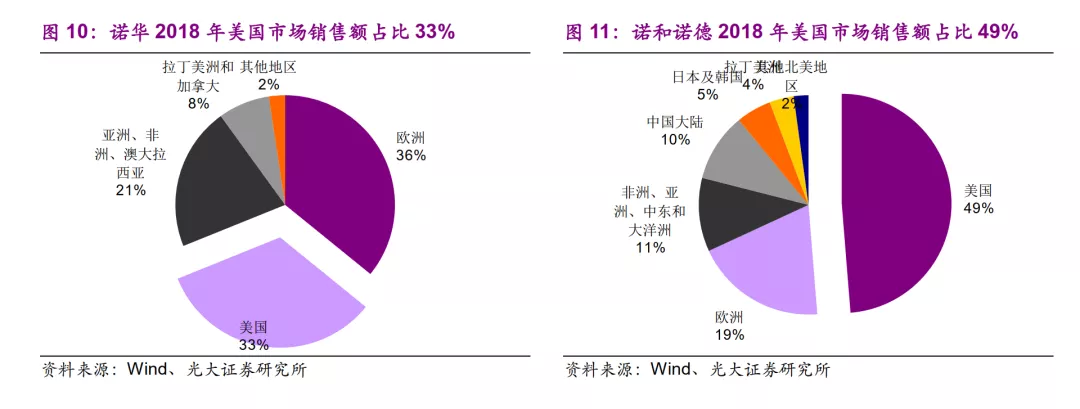
从全球跨国药企的营收构成来看,美国市场销售额占其全球销售额的比重都非常高,不管是美国本土的药企还是其他国家的药企都是这样,以2018年销售额为例:
1)美国本土药企:辉瑞(PFE.US)占比47%,礼来(LLY.US)占比57%;
2)其他国家的跨国药企:瑞士的诺华占比33%,丹麦的诺和诺德占比49%。
综合来看,美国市场是支撑起全球跨国药企创新药销售体量的核心支柱,或者说是战略制高点。
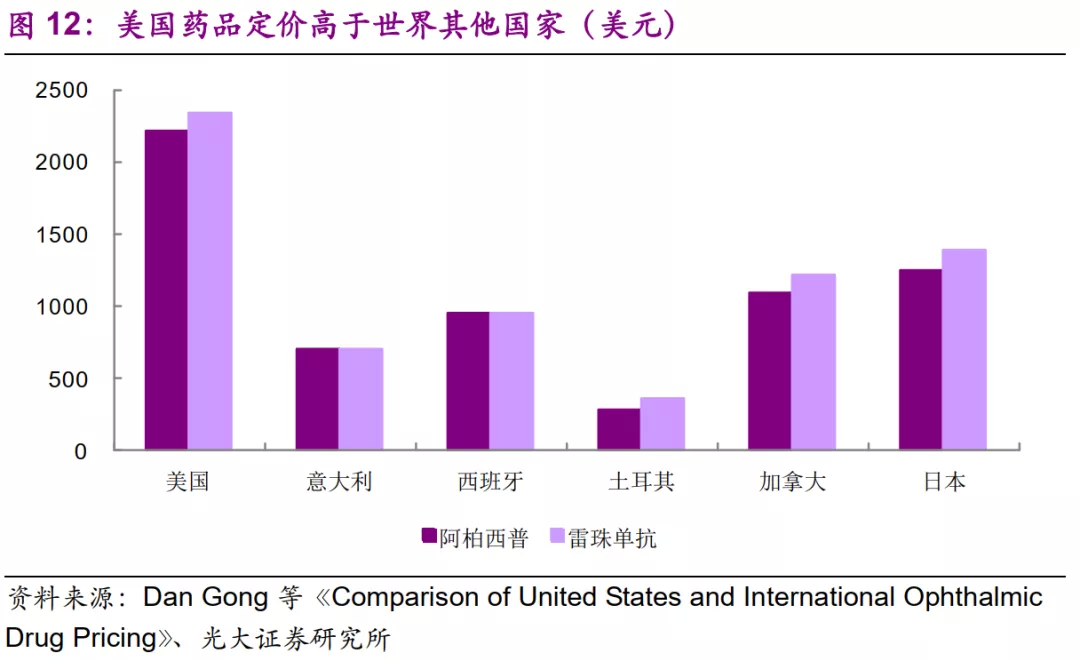
2.1.2、全球“价格高峰”造就高销售额
美国创新药高销售额的重要原因之一是创新药的高定价。以眼科用药阿柏西普、雷珠单抗为例,在美国这两款药物的销售价格均超过2000美元,而西班牙、加拿大、日本仅为1000美元左右,土耳其则不足500美元。同样一款药物往往在美国能获得更高的定价,在有限的患者基数下贡献巨大的销售额。
2.1.3、自由定价背后的复杂药品资金链
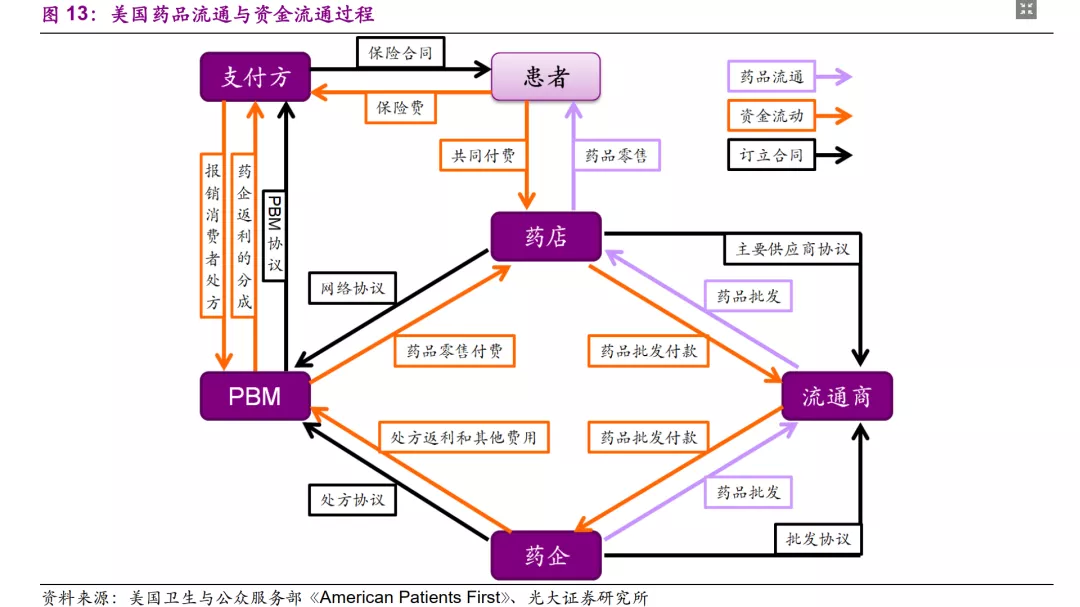
美国政府并不直接限制药品价格,经过数十年的发展,美国药品市场发展出了一套复杂的药品自由定价模式。与药品相关的资金流动包括:
患者:
资金流出:①缴纳保费;②药品的自付费部分;支付方(包括商业保险和Medicare和Medicaid等政府医保):
资金流出:向PBM支付患者的处方报销费用;
资金流入:①患者缴纳的保费;②PBM支付的药企返利(rebate)分成;PBM:
资金流出:①患者购买药品的部分付费;②向支付方返还部分药企返利的分成;
资金流入:①支付方的报销金额;②药企的处方返利和其他费用;药店:
资金流出:向药品流通企业支付药品批发款;
资金流入:①患者自付费;②PBM付费;流通商:
资金流出:向药企支付药品批发款;
资金流入:向药店收取药品批发款;药企:
资金流出:向PBM支付处方返利和其他费用;
资金流入:向流通商收取药品批发款。复杂的支付结构下的自由定价是导致美国的药价成为全球“价格高峰”的重要原因。
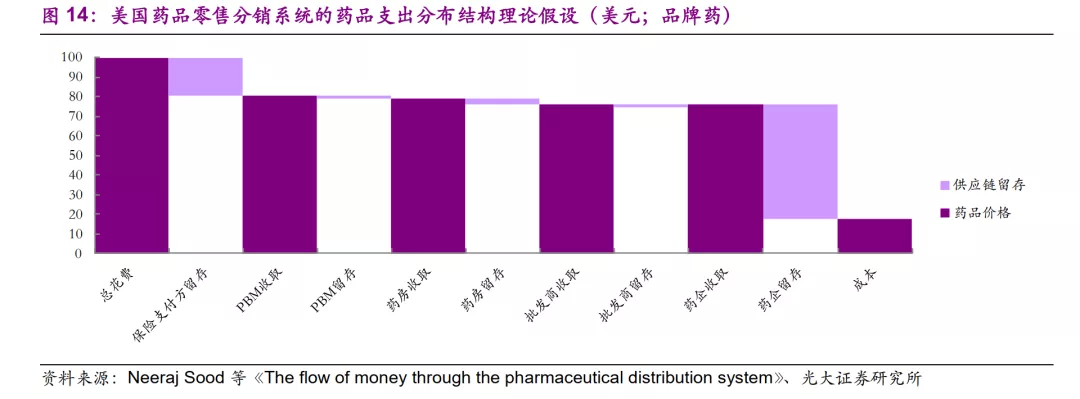
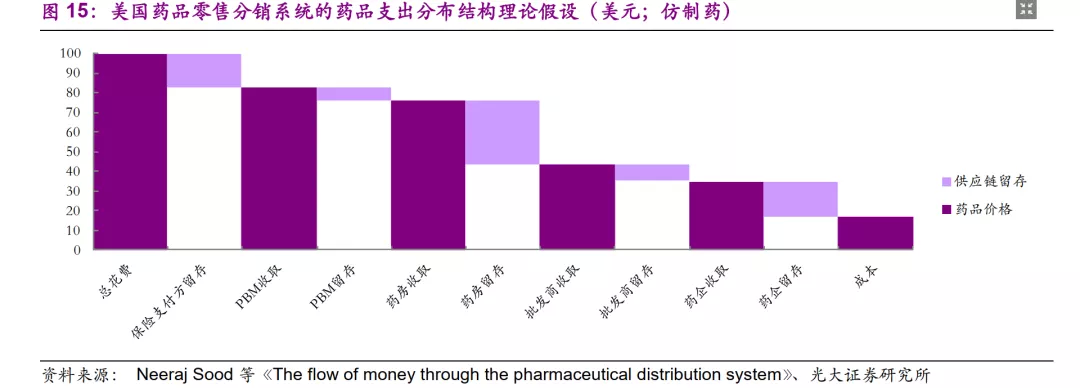
药品以净价格(Net Price)从药企出厂之后,经过各个环节流通与报销的层层加价,最终形成目录价格(List Price)。Neeraj Sood等发现,对于终端100美元的药价,品牌药的出厂价约为76美元,而仿制药的出厂价仅为35美元。
2.1.4、返利制度导致保险可以支持高价药
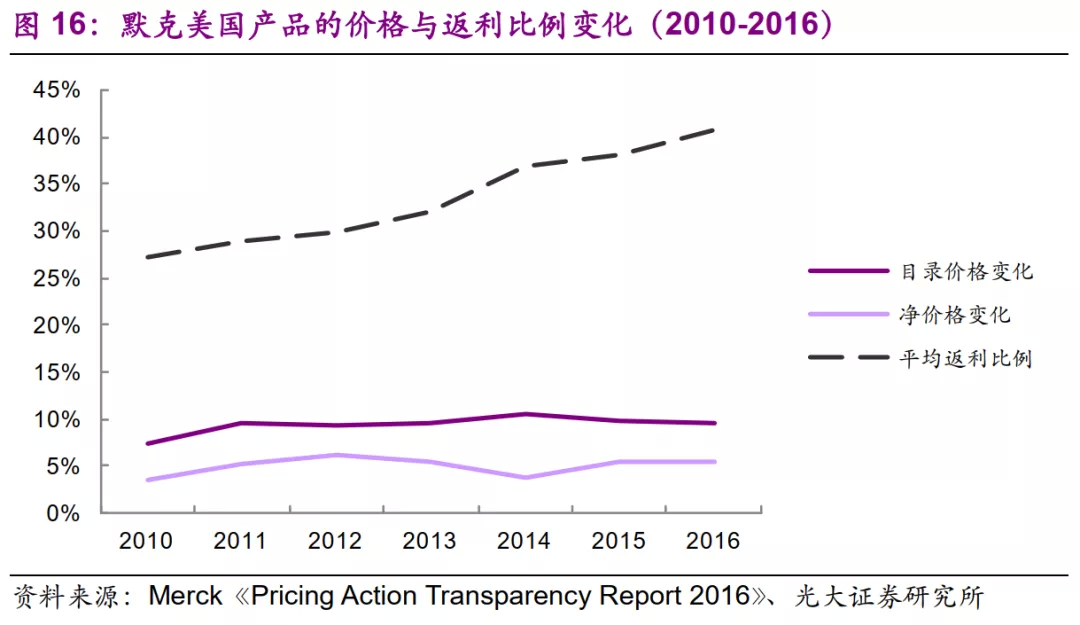
由于返利(rebate)制度的存在,保险-PBM-药企形成了强大的药品“价格同盟”。美国公共利益医学中心(Center for Medicine in the Public Interest, CMPI)副主席Robert Goldberg在2017年撰文指出,PBM产生了近1300亿美元的返利,几乎是制药业每年3490亿美元总收入的30%。PBM在向药企收取返利之后,又将其中一部分传递给与其签约的保险公司。
根据美国默克公司发布的《Pricing Action Transparency Report 2016》所公布的默克美国产品价格与返利变化数据,从2010-2016年,默克的目录价格增速(10%左右)持续高于净价格的增速(5%左右),而平均返利的比例则持续上升,截至2016年已经高达40.9%。
通过PBM的返利分成,保险实际承担的报销金额得到有效降低,从而更容易接受对高价药的报销。而美国的患者则需要参与保险计划才可获得一定比例报销,否则便需要自费承担高昂的药品价格。
2.2、比价与成本计算(日本):给予高临床价值更多溢价
2.2.1、日本国内市场:支撑创新药的沃土
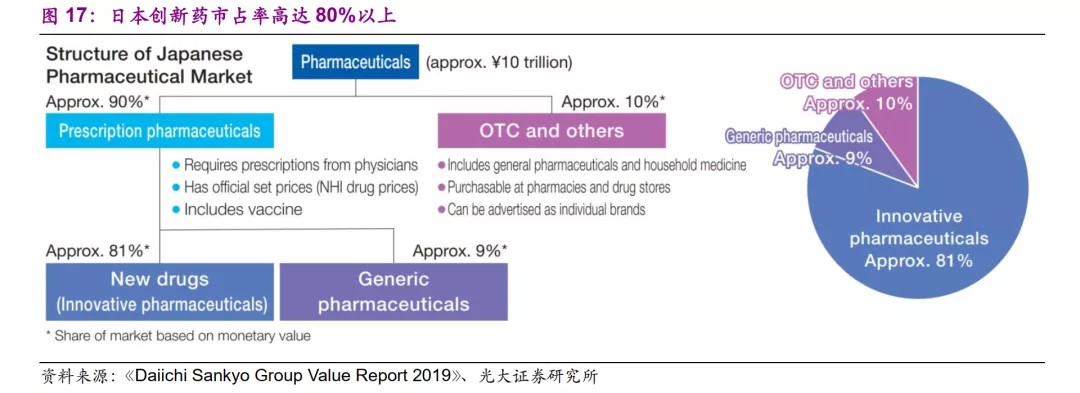
日本国内药品市场销售额约有90%左右是处方药,其中又有81%左右是创新药。日本国内的创新药产业较为发达,参考图12亦可发现,日本的创新药定价水平也相对较高。
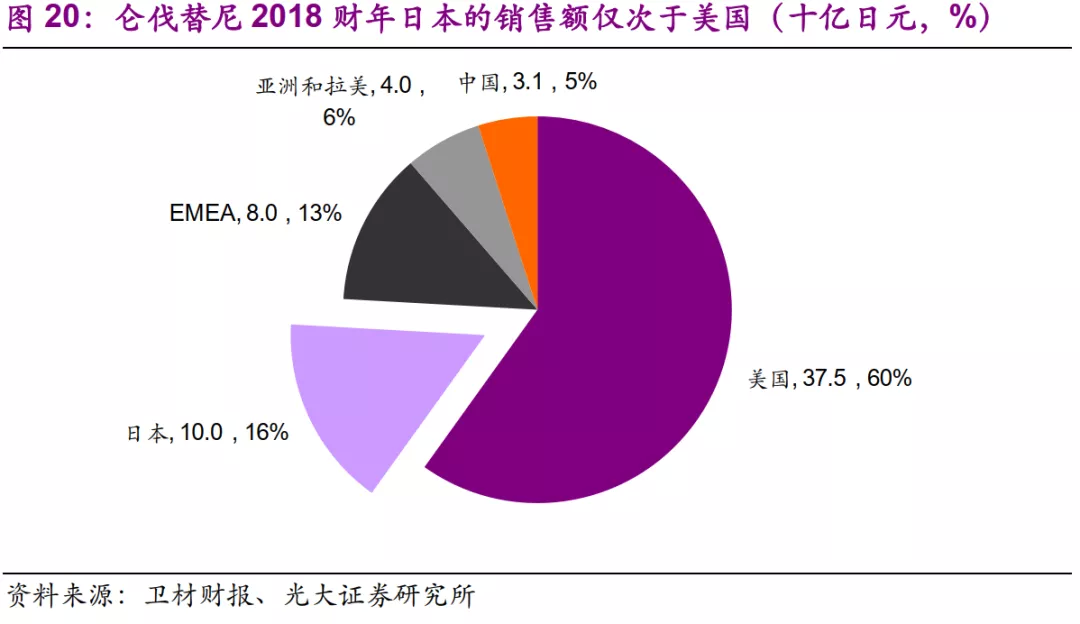
从日本跨国创新药企业的收入结构来看,日本市场均占有较高的比例,2018财年,武田的日本收入占比达到27%,卫材的日本收入占比达到53%。卫材的重磅创新药仑伐替尼,于2015年在美国、日本、欧洲获批上市,2018年在中国获批上市,其2018财年的收入结构中,日本市场占比达到16%,仅次于美国市场。
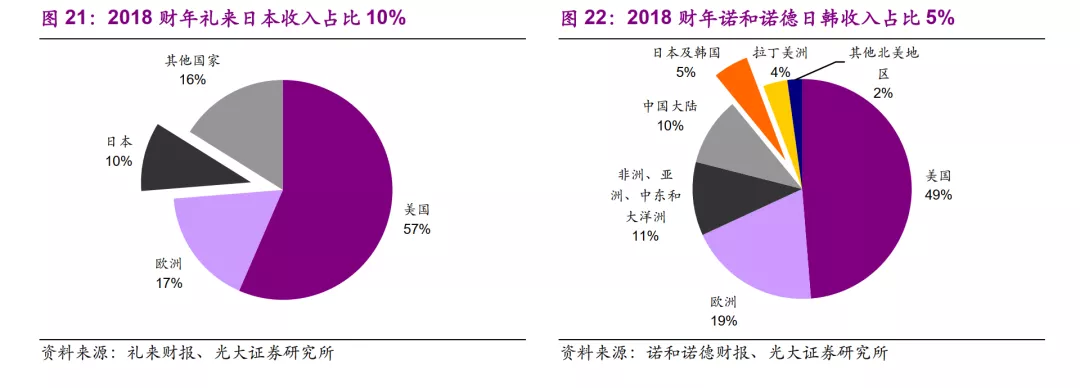
对于其他国家的跨国药企来说,日本市场同样具有相当重要的地位,在2018年礼来全球收入中,日本市场占比高达10%,诺和诺德的日韩市场占比则达到5%。
综合来看,对于全球跨国药企来说,日本是创新药放量的重要市场。

2.2.2、日本医保体系:三大保险实现全民健康覆盖
1961年,通过政府主导的社会福利措施,日本实现了全民健康覆盖(Universal Health Coverage, UHC)。日本3,000多家保险公司提供三种保险类型:
1)基于雇主的健康保险,细分为3个计划:
a)健康保险协会(Health Insurance Societies)管理计划,主要针对大公司,由1300多家保险公司提供,并在出现财务困难的情况下有资格获得公共补贴。截至2016年8月,健康保险协会计划的参保人数为2917万,截至2017年4月1日,共有1357个协会。
b)互助协会(Mutual Aid Associations, MAAs)管理计划,针对政府工作人员,没有资格获得公共补贴。截至2014年3月底,共有85个MAA,注册人数为891万。
c)日本健康保险协会(Japan Health Insurance Association, JHIA)管理计划,针对中小型公司的员工。除了参保人保费之外,JHIA的大部分财务来源还包括健康保险协会的保费和公共资金。截至2016年8月,JHIA计划的注册人数为3718万。JHIA实质上承担着基于雇主的健康保险的安全网的角色。
2)基于居民的国家健康保险:基于居民的国民健康保险(National Health Insurance, NHI)系统是涵盖75岁以下的自雇、失业和退休人员的健康保险计划。参保者要缴纳保险费,但是实际的50%的福利费用由公共资金支付。
3)老年人健康保险:老年人医疗制度于2008年引入,所有75岁及以上的人都必须参保。由于参保人自己支付的保费仅能支付大约10%的医疗费用,因此,老年人补贴医疗系统将获得公共补贴以及上述两个保险计划的财政调整的支持。
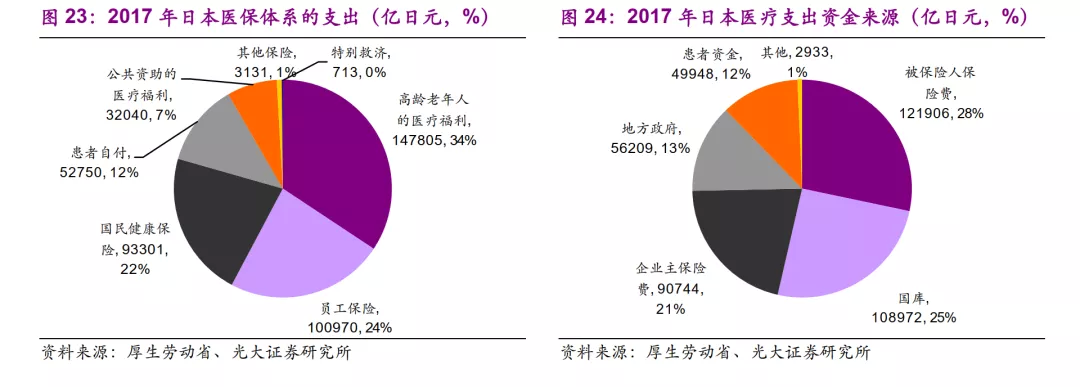
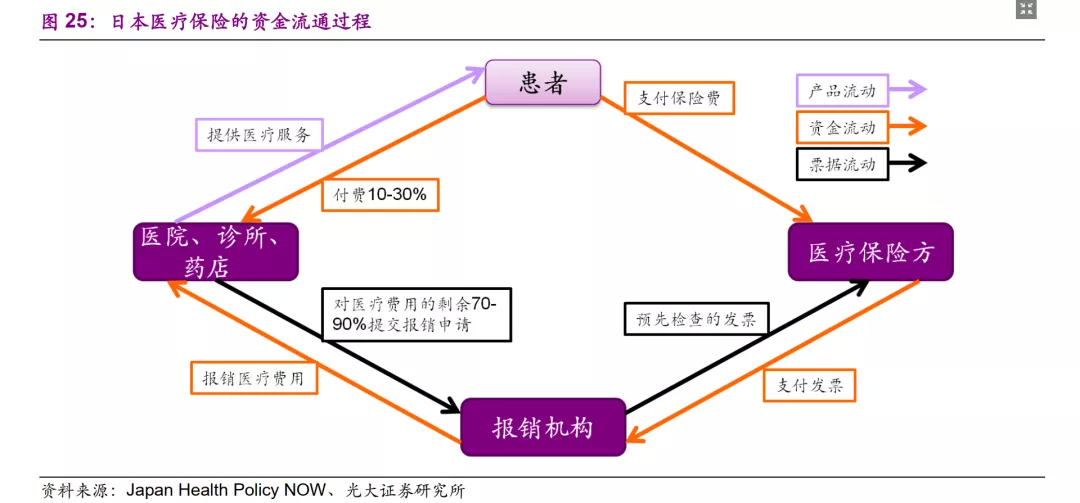
当携带保险证明的患者前往医疗服务提供方(如医院、诊所、药店)时接受诊疗服务时,会根据其年龄和收入支付10~30%的共同保险,已发生医疗费用的剩余70~90%由公共资金支付,这些资金来源是保险费和税费等。医保覆盖的医疗服务提供方将相应70~90%的费用报销给索赔审查和报销组织(Claims Review and Reimbursement Organizations, CRRO),例如健康保险索赔审查和报销服务(Health Insurance Claims Review & Reimbursement Services, HICRRS)和国家健康保险协会联合会。CRRO审查保险索赔是否合理,从保险公司处收取费用然后将其支付给提供方。
2.2.3、日本药品定价体系:赋予创新临床价值更高溢价
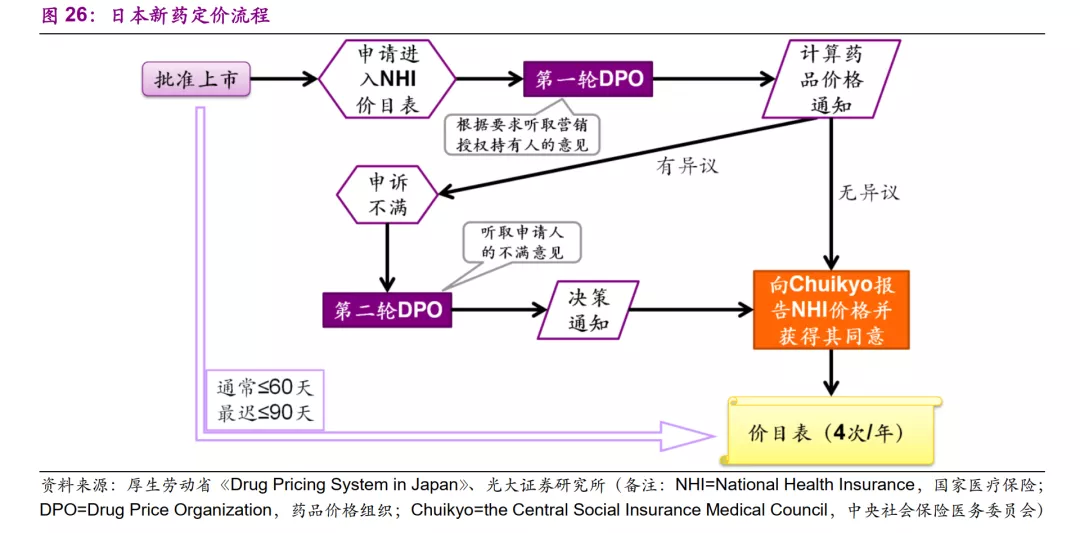
日本新药获批上市后,若申请进入国家医保(NHI)目录,则需要进行1~2轮谈判。计算药品价格主要通过药物经济学方法进行,得出计算结果后根据有无异议来进入第二轮谈判或向中央社会保险医务委员会(Chuikyo)报告价格,最终进入NHI价目表。整个过程通常在60天以内,最迟不超过90天。
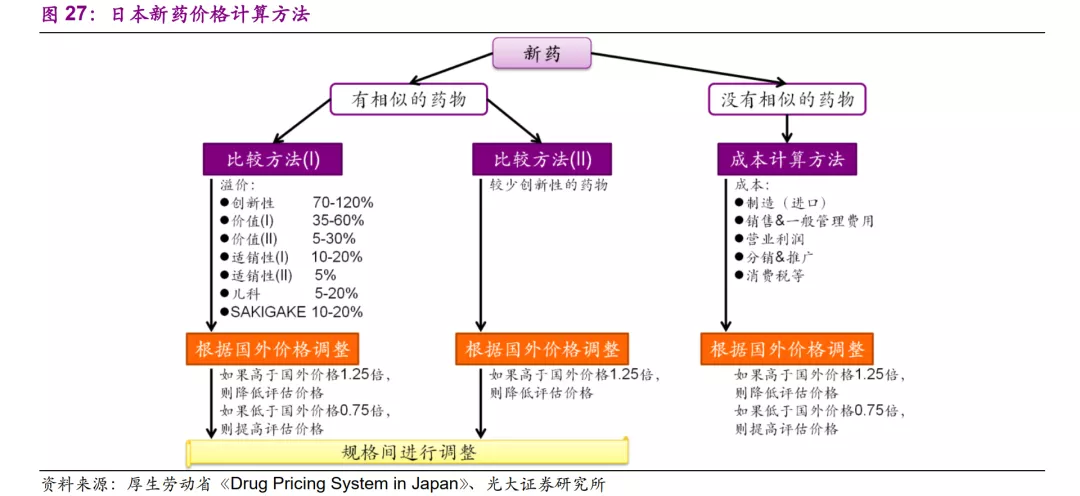
日本新药价格的计算方法主要由三种途径组成:
1)有相似的药物:
a)创新性较强的药物采取比较方法(I),根据规则给予一定创新溢价;
b)创新性较少的药物采取比较方法(II),直接与可比药物进行定价。
2)没有相似的药物:采取成本计算方法。
A.有相似药物、创新性强的比较方法(I)
对于有相似药物、创新性较强的药品,适用比较方法(I),可以根据其创新溢价、价值溢价、适销性溢价、儿科溢价、SAKIGAKE溢价等规则给予更高定价。


B.有相似药物、创新性弱的比较方法(II)
对于创新性较弱的新药,则适用比较方法(II),将价格定位过去几年中进入NHI价目表的同类药物中的最低价。对于创新性较弱的新药的评价标准需要满足以下标准:
该药物不符合任何溢价标准;
市场上已经有超过3种同类药物可用。通常,该药物的价格取以下两者中较低者:
过去6年内同类药品的最低每日价格;
过去10年内同类药品的平均每日价格。如果以上选择的最低价格高于基于相似药效的药物计算价格,则将该价格与以下两个选项进行比较以选择最低的价格:
过去10年内同类药品的最低每日价格;
过去15年内同类药品的平均每日价格。
C.无相似药物的成本计算方法
对于没有相似药物的创新药,则采用成本计算定价,考虑因素包括原材料、人工、制造的成本,推广、研发、分销的费用,以及营业利润率和消费税率,综合各项成本、费用率、利润率得出药品定价计算结果。

D.根据国际价格调整
将比较定价或成本定价得到的价格与国外价格进行比较,如果价格差异较大,则应重新计算和调整价格:
1)国外平均价格:美国、英国、德国、法国的平均价格;
2)价格调整:
a)≥平均价格的1.25倍,则降低价格,计算方法为(1/3×计算价格/国外平均价格+5/6)×国外平均价格;
b)≤平均价格的0.75倍,则提高价格,计算方法为(1/3×计算价格/国外平均价格+1/2)×国外平均价格;(注:最大价格增加幅度是2倍)
在以下情况下不可根据国外价格进行提价:
价格计算基于比较方法(II)(低新颖度药物)。
有多种规格同时受到国外高价和低价的影响;
有多种药品规格,其中只有非通用规格受到定价影响。
只有一个国外价格可用于价格调整。在以下情况下不可根据国外价格进行降价:
该药物是根据要求或由日本厚生劳动省公开招募而开发的,其基础是未经批准药物特别委员会和医疗保健急需超适应症用药特别委员会的讨论结果。
自从在国外获得批准以来至少已有10年。
计算得出的价格大于国外平均价格的3倍。
E.其他定价规则
对于部分较为特殊的药品,有其他相应规则进行调整,如不同规格间的调整、药品套件产品(如预填充注射剂)、复方制剂、外消旋体等。
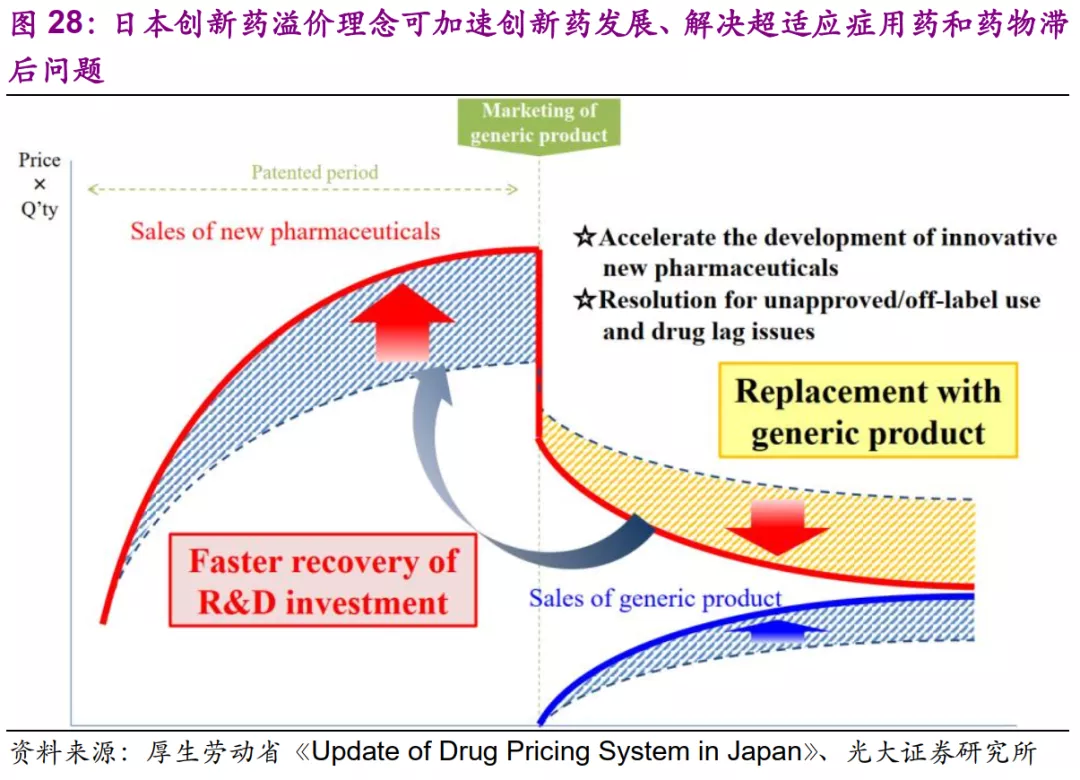
通过科学合理的比价和成本计算体系,赋予高临床价值的创新药更高溢价,日本有效的促进了创新药产业的发展,改善了超适应症用药和药物审批滞后的问题,既提升了本国人民的创新药可及性,也支持了日本药企跻身全球一流创新药企的行列。
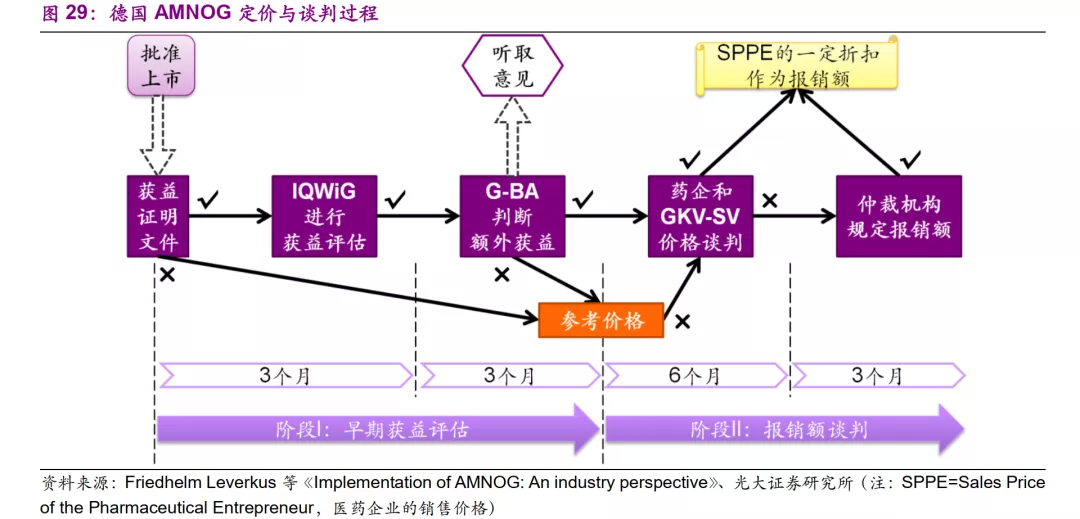
2.3、谈判定价(德国):基于额外获益进行价格谈判
德国联邦议会(Bundestag)在2010年通过医疗技术报销的新法律,称为AMNOG(Arzneimittelmarktneuordnungsgesetz),旨在实现每年节省22亿欧元的疾病治疗资金的政治目标。根据新法律确定报销决策的过程包括两个阶段:
(1)早期获益评估
在新产品上市时,制造商需要提交获益证明文件(Benefit Dossier),以表明新产品相对于疗法具有更多临床获益,具体由联邦联合委员会(Gemeinsamer Bundesausschuss,G-BA)确定。G-BA是德国医师,牙医,医院和健康保险基金的最高自治决策机构,G-BA通过医疗质量和效率研究所(Institut fur Qualit at und Wirtschaftlichkeit im Gesundheitswesen, IQWiG)来进行获益评估。IQWiG是专业独立的科学研究机构,由保险公司提供资金。
(2)报销额谈判
收到IQWiG的建议后,G-BA最多有3个月的时间来判断新产品相对于参比疗法的优势:
如果G-BA认为新产品无额外获益,则将进入固定的参考价格组。如果不存在固定的参考价格组,则新产品的最高报销价格就是所选参比疗法的价格。
如果G-BA认为新产品有额外获益,则将邀请制造商与国家法定健康保险协会(Spitzenverband der gesetzlichen Krankenkassen, GKV-SV)进行价格谈判。GKV-SV产品价格必须在6个月内商定。议定的价格在提交获益证明文件(或产品上市)后12个月生效。在这12个月中,制造商可以设置产品的价格。如果谈判未达成协议,则任何一方都可以向仲裁委员会提出上诉(根据SGBV第130b条)。委员会将确定产品价格,该价格将追溯适用。德国AMNOG法案所规定的两个阶段的议价过程充分体现了新药额外获益的重要性。

3、大医保时代的创新药经济学定价:临床价值即定价筹码
3.1、医保谈判定价时代到来,药物经济学成为理论基础
在2017年的国家医保谈判中,相关部门组织了药物经济学评估组对药品的临床应用价值进行评估,这是药物经济学在国家医保谈判中的首次应用。在2019年医保谈判中,国家医保局专门组织了药物经济学测算专家组,遴选近40位专家,对150个药物进行药物经济学评审。复旦大学公共卫生学院的胡善联教授总结了本次谈判中药物经济学测算过程的5个亮点:
1)结合中国经济水平,探索适合中国药物经济学评审的成本效果阈值,同时运用药物经济学模型进行底价测算;
2)充分运用国际参考价格,以10个发达国家、亚洲国家和境外地区的价格作为参考,鉴于我国市场规模大,希望谈判价格低于国际最低的参考价格;
3)充分发挥市场竞争的作用,对同类药品(如丙肝直接抗病毒药物)通过竞争性谈判,选取质优、最低的价格品种;
4)测算新药进入目录后可能带来的预算影响,续约药品分析上市报销后的药品实际销售情况,若超出预算目标则需要按比例进一步降价;
5)中成药谈判中祖传经验方和有规范的临床试验,药物疗效优于市场上已有中成药,而且价格合理的药物
从已公布的谈判降价幅度来看:
降幅较小的药物,多为较少替代治疗方案、临床优势强大的刚需用药。如用于眼科AMD/DME/CNV的创新药康柏西普(直接竞争者仅雷珠单抗、阿柏西普,并无其他理想疗法)降幅仅25%,用于外周T细胞淋巴瘤的创新药西达本胺(国内无直接竞争者,几乎是该类患者唯一靶向治疗选择)降幅仅有11%;
降幅较大的药物,多为替代方案较多、临床优势不明确的药物。如丙肝DAA类药物(药物经济学原理详见下文3.4部分)平均降幅85%、SGLT2降糖药达格列净(国内共有5家企业拥有同类药品获批上市)降幅73%、用于慢性肝病引起高血氨症辅助治疗的精氨酸谷氨酸降幅85%。
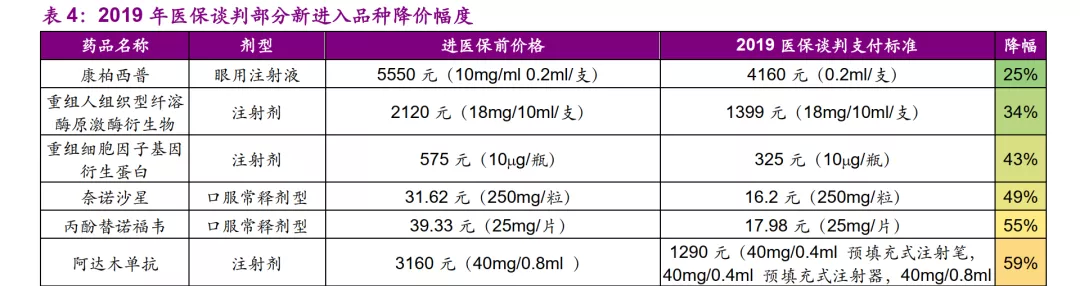
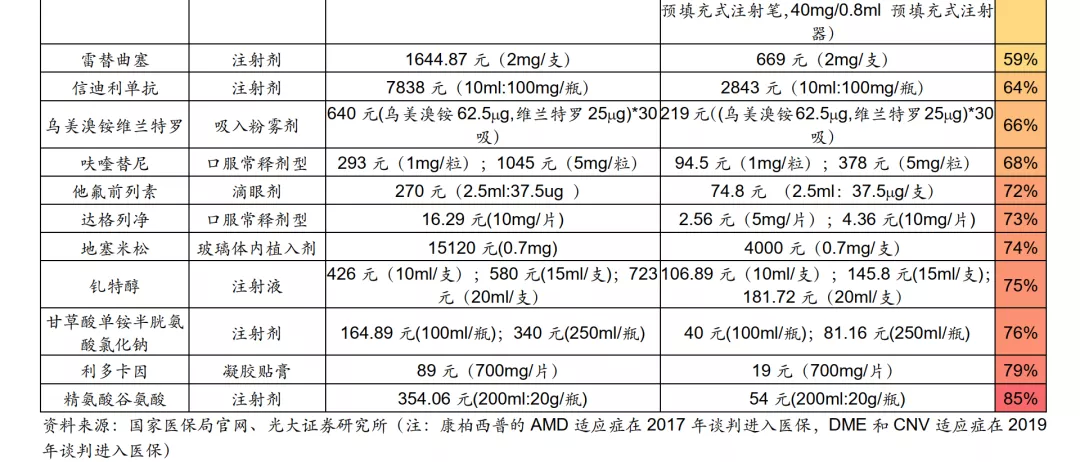
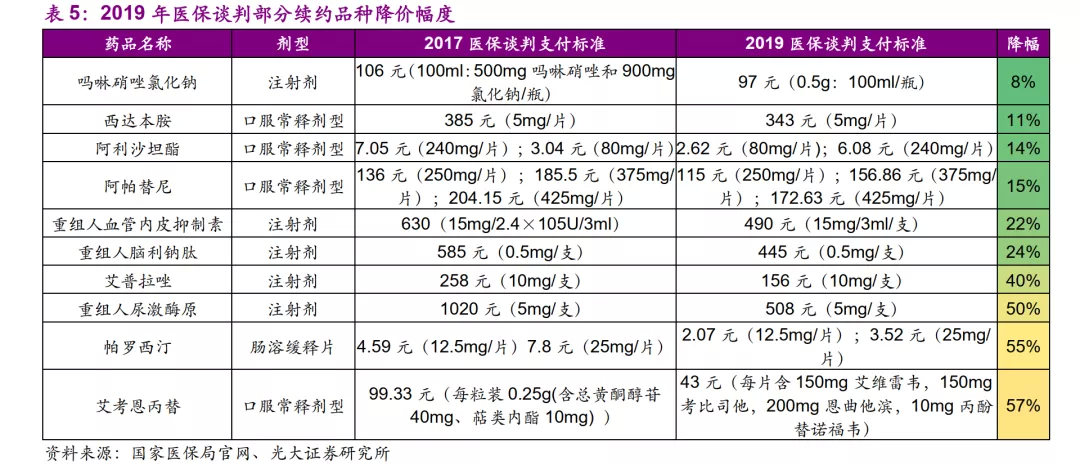
从谈判结果来看,医保局已经熟练使用药物经济学方法对创新药的价格进行谈判,我们判断创新药的药物经济学将成为未来主导定价的核心方法论之一。
从国际经验来看,基于成本效果分析的药物经济学进行定价谈判是多个发达国家市场的常用方法。而药物经济学评价方法将有较大可能性采取当前世界较为流行的成本效果分析评价方法。
3.2、医保支付方式改革大潮之下,药物经济学将引导医疗机构用药行为
2020年3月5日,国家医保局发布《中共中央 国务院关于深化医疗保障制度改革的意见》,在第十四条“持续推进医保支付方式改革”中,要求大力推进大数据应用,推行以按病种付费为主的多元复合式医保支付方式,推广按疾病诊断相关分组付费,医疗康复、慢性精神疾病等长期住院按床日付费,门诊特殊慢性病按人头付费。
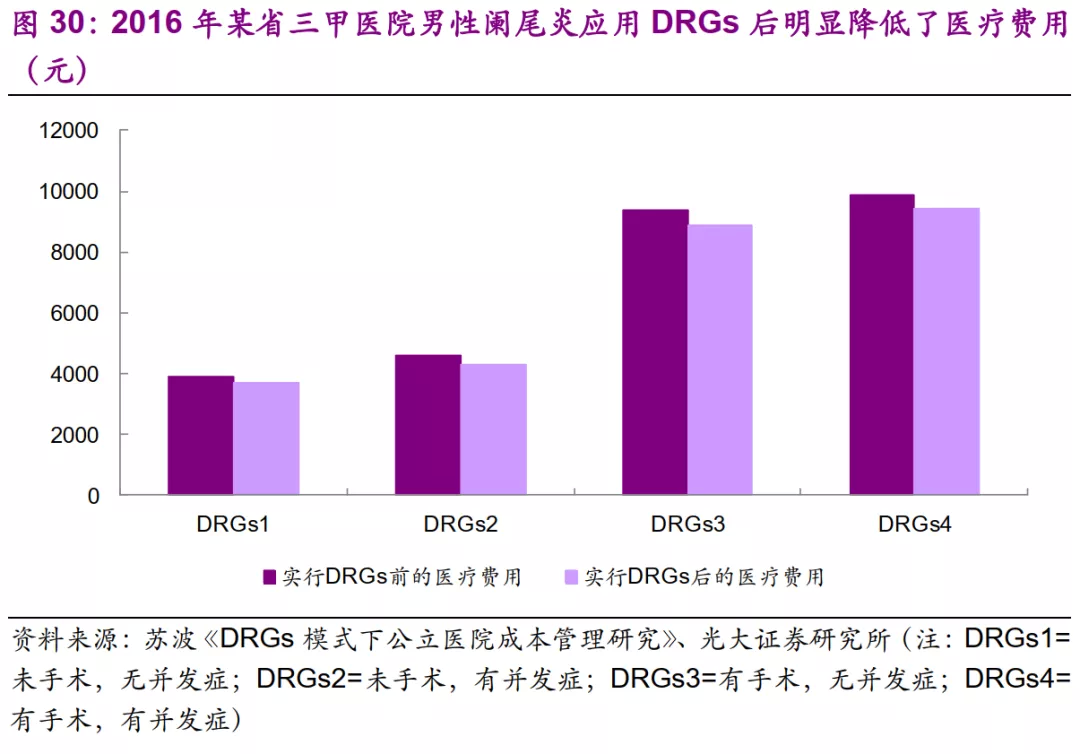
按疾病诊断相关分组(DRGs)的结算方式注重成本核算,使医疗机构有了更强的控费动力。根据部分试点医疗机构的结果来看,DRGs在实施之后明显降低了医疗费用。未来随着DRGs等医保支付方式的全面推广,在药物经济学上占据优势的治疗方法将更受医院的青睐。
3.3、何为增量成本效果——以替格瑞洛与氯吡格雷为例
考虑到成本效果评价将可能成为主要的药物经济学方法论,我们以替格瑞洛和氯吡格雷为例,探讨二者在该种药物经济学评价方法上的表现:
替格瑞洛是阿斯利康研发的用于急性冠脉综合征(ACS)的创新药,该药物于2011年在美国上市,2012年在中国上市。该领域的主要竞争对手之一是赛诺菲研发的氯吡格雷。
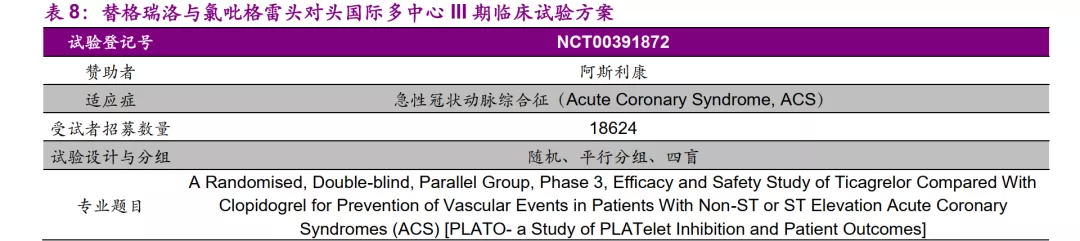
为确认替格瑞洛在减少ACS患者因血管性原因、心肌梗死和卒中导致的死亡方面是否优于氯吡格雷,阿斯利康于2006年10月启动了一项代号为“PLATO”的国际多中心III期头对头临床,该试验于2009年3月完成。
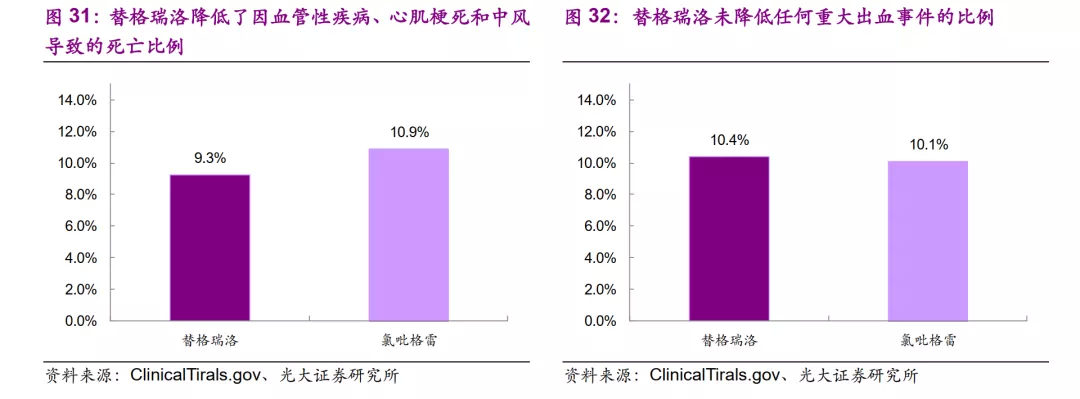
试验结果显示,替格瑞洛组在因血管性疾病、心肌梗死和卒中导致的死亡比例(9.3%)低于氯吡格雷组(10.9%),但在重大出血事件的指标上则未表现出优势。
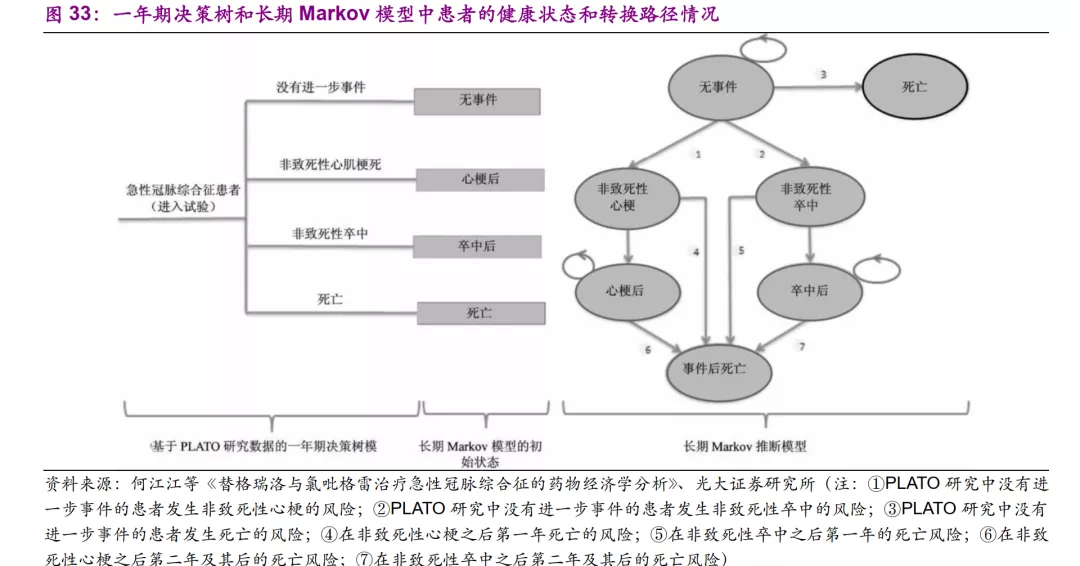
我们在此参考何江江等人于2013年发表的《替格瑞洛与氯吡格雷治疗急性冠脉综合征的药物经济学分析》中对于该两种药物的药物经济学分析模型,包括两部分:
1)基于PLATO研究数据的一年期决策树模型;
2)用于长期外推的Markov模型。
对于两种药物采取增量成本效益(Incremental Cost-Effectiveness Ratio, ICER)分析,其计算公式为:
ICER=(C替格瑞洛-C氯吡格雷)/(Q替格瑞洛-Q氯吡格雷)=△C/△Q
其中C表示估计的平均成本,Q表示估计的平均质量调整生命年(Quality-Adjusted Life Years, QALYs)。若△C<0,△q>0,则视为优势治疗策略,不再计算ICER值。
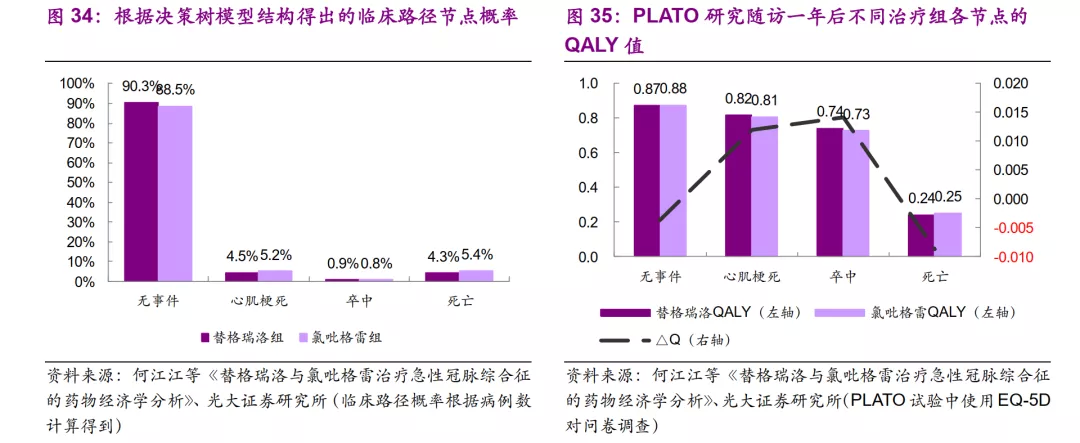
通过资源消耗的成本(医疗资源单价参考2010年上海市药品、医疗器械和服务项目价格列表)计算可发现,替格瑞洛组的无事件、卒中、死亡三种节点下,成本均低于氯吡格雷,仅有心肌梗死略高。
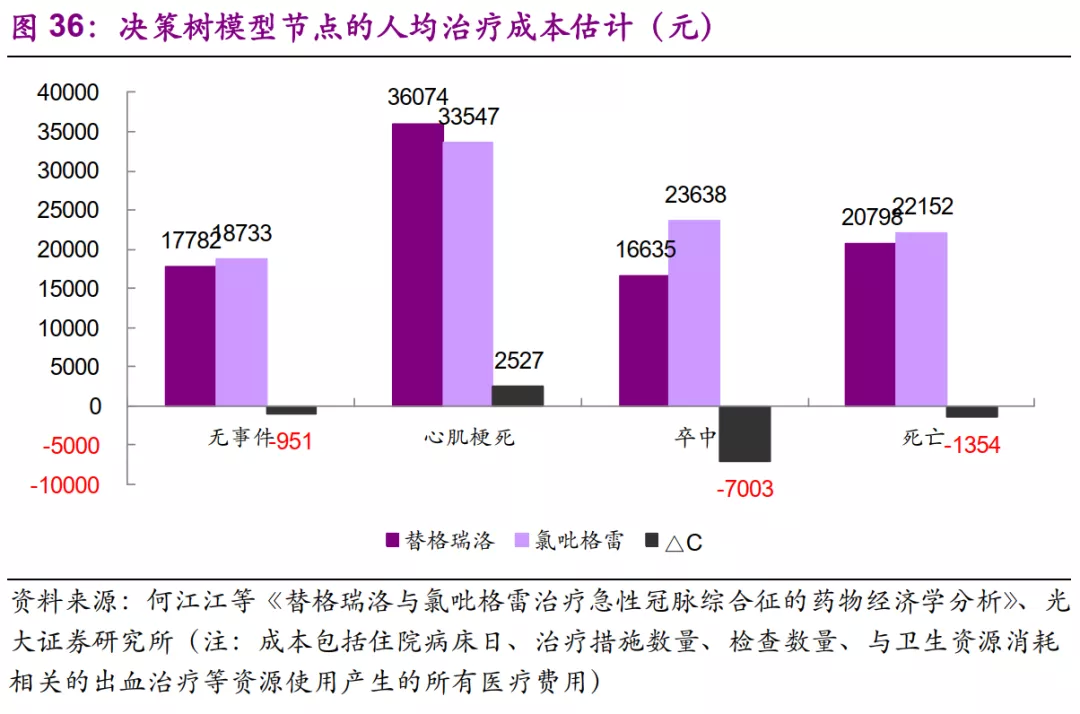
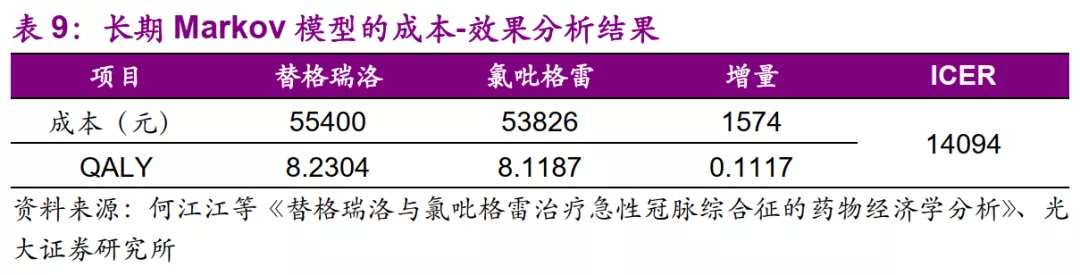
在长期Markov模型中,与氯吡格雷相比,替格瑞洛治疗的终生效果是QALY每增加0.1117个单位,所需增量成本为1574元,ICER=1574/0.1117=14094元/QALY。
根据WHO关于药物经济学评价的推荐意见:
ICER<人均gdp:增加的成本完全值得;
人均GDP<icer<3倍人均gdp:增加的成本可以接受;
ICER>3倍人均GDP,增加的成本不值得。参考上海市2010年人均GDP为76074元,高于替格瑞洛-氯吡格雷的ICER,因此替格瑞洛更具有成本-效果,增加的成本完全值得。
3.4、为何降价惨烈——19年医保谈判丙肝药背后的经济学原理
2019年底的医保谈判中,丙肝类创新药以平均85%的降幅成为此次医保谈判中降价最为剧烈的品类,而其背后同样有药物经济学原理的支撑:
2011年之前,聚乙二醇干扰素联合利巴韦林(简称PR方案)是丙肝的标准疗法,病毒学治愈的判断标准是治疗结束后12周测定患者血清丙肝病毒RNA,成为持续性病毒学应答(Sustained Virologic Response, SVR12)。
2011年之后,多个直接抗丙肝病毒药物(Direct-acting Antiviral Agent, DAA)获批上市,可使SVR12率提高到90%以上。市场上的多个DAA治疗方案彼此间有一定的增量成本效果差异。
胡善联教授等人于2018年发表的《直接抗丙型肝炎病毒药物的成本效果比较分析》采用我国丙肝患者主流的1b基因型治疗方案进行了药物经济学测算。
丙肝病毒基因1b型(以下简称“GT1b”)患者使用DAA治疗可以明显提高治疗效果,从52-70%提升到91-99%。五种DAA疗法中,SVR12率每提升1%的价格,以达诺瑞韦方案最低,仅为93元/1%SVR12(相对PEGα-2a)或325元/1%SVR12,之后依次为奥比帕利、达拉他韦+阿舒瑞韦、索磷布韦。
由于各种DAA药物均已实现90%以上的SVR12率,相较于传统PR疗法方案的临床获益非常接近,因此若要实现更大的增量成本效果,唯有降价一条路线可选。
由于临床价值并无太大强弱差异,因此在后续的医保谈判中,降价成为胜出的主导因素,这也就是2019年医保谈判中丙肝类创新药降价幅度最大的药物经济学原理。
3.5、定价高的药物也有可能更经济——艾美赛珠单抗降低了血友病A的预算
尽管增量成本效果的药物经济学评价对于药品费用提出了考量,但创新药并非只有降价一条路可走,若创新药的临床获益足够优秀,同样有可能在定价更高的情况下实现更加经济的整体医疗费用。例如艾美赛珠单抗,尽管定价不低,但综合的临床获益却更加经济:
A型血友病(Hemophilia A,HA)是一种罕见的先天性出血病,由X染色体突变引起,导致凝血因子VIII(FVIII)突变或缺失。重度患者会反复发作自发性和创伤后出血,严重影响患者的生活质量(quality of life, QoL)。
HA治疗目前主要基于输注FVIII浓缩物以控制出血(按需治疗)或预防出血及其对关节和肌肉的损害(预防疗法)。但FVIII的抑制性同种抗体会导致替代疗法部分或完全失效。先前未经治疗的严重HA患者中,有25%~30%的患者会产生抑制物,该类患者发生严重出血、致残和发病的风险较高,QoL受损严重,医疗费用较高。
针对有抑制物的HA患者,国际指南首推的治疗方法通过免疫耐受诱导(Immune Tolerance Induction, ITI)永久清除抑制物。在ITI失败的HA患者中,治疗或预防出血则基于以下两种旁路制剂(bypassing agents, BPA):
活化凝血酶原复合物浓缩物(activated Prothrombin Complex Concentrates, aPCC);
重组活化FVII(recombinant activated FVII, rFVIIa)。然而该类预防疗法仍然有相当比例的出血事件,患者应答情况也不甚理想。
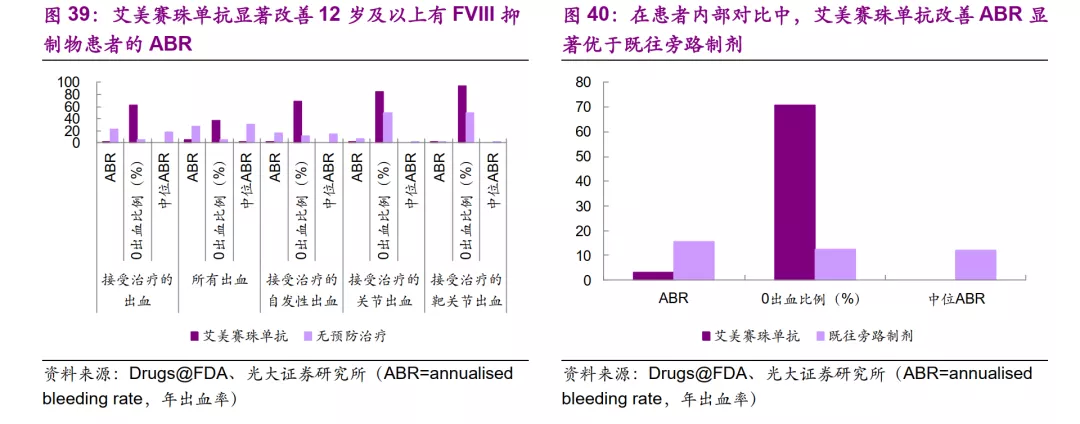
罗氏开发的艾美赛珠单抗/Emicizumab(商品名:舒友立乐/HEMLIBRA)是一种每周给药一次的双特异性抗体,用于存在凝血因子 VIII 抑制物的 A型血友病(先天性凝血因子 VIII 缺乏)成人和儿童患者的常规预防性治疗以防止出血或降低出血发生的频率。临床试验结果证明,艾美赛珠单抗可显著改善存在FVIII抑制物患者的生活质量,且显著优于既往应用过的的旁路制剂。
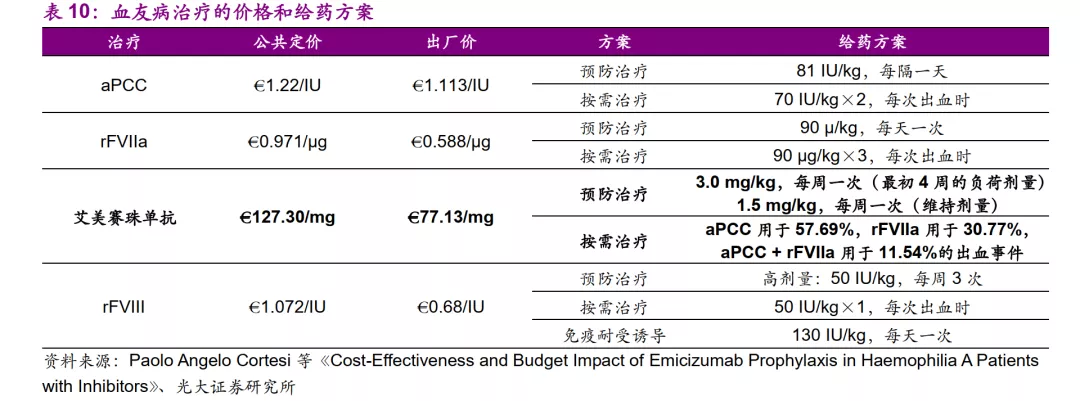
Paolo Angelo Cortesi等研究者对于艾美赛珠单抗进行了成本效果分析,成本包括:
1)治疗费用(BPA,艾美赛珠单抗和rFVIII)。参考意大利NHS(National Health Service,国家卫生服务系统)支付的最高价格,见下表。根据按需BPA的年出血率28.7,预防BPA的年出血率7.9,预防艾米珠单抗的年出血率2.9,预防rFVIII大剂量的年出血率2.0和ITI的年出血率3.0进行总体治疗成本计算;
2)大手术(关节成形术)。根据已公布的经济分析,预防或ITI治疗的人工关节置换术的概率为每年0.08%,按需治疗为每年2.30%。根据住院费用和围术期应用aPCC的人工关节置换的费用为462,820欧元;
3)其他直接费用(拜访,检查,住院等)。按需治疗和预防方案的其他直接成本根据医疗保健资源消耗进行估算的。
根据临床试验数据,平均每例接受艾米珠单抗预防的患者住院2.6天,而同样方法测算BPA预防患者住院3.9天。基于DRG模型测算每天的住院费用为137.4欧元。
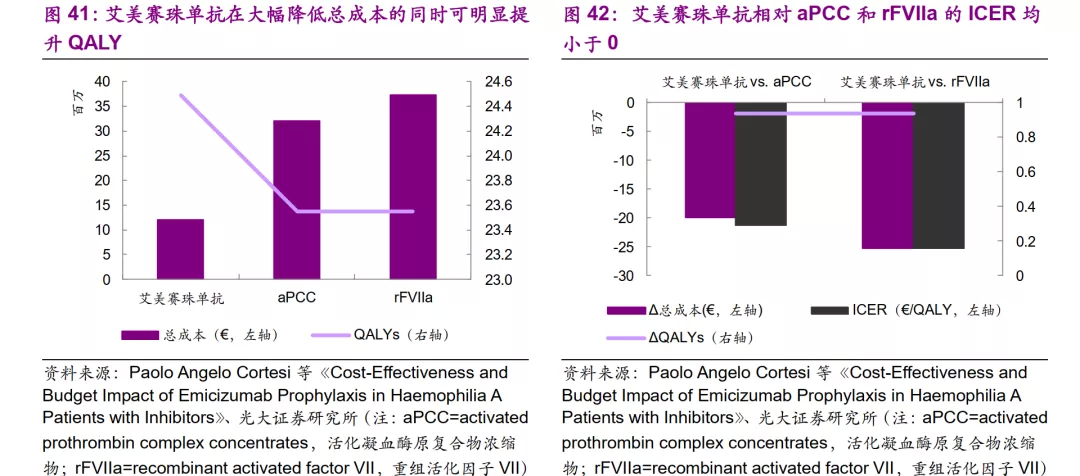
从临床获益来看,艾美赛珠单抗的预防效果比aPCC和rFVIIa的预防效果更好。接受艾美赛珠单抗预防的患者的QALY估计值为24.49,而接受BPA的患者的QALYs为23.55。
从治疗成本来看,艾美赛珠单抗预防治疗也更加便宜,约为1,216万欧元/人;rFVIIa预防费用最高为3,743万欧元/人。与rFVIIa和aPCC预防治疗相比,采用艾美赛珠单抗预防治疗的每位患者分别节省了2520万欧元和1998万欧元。
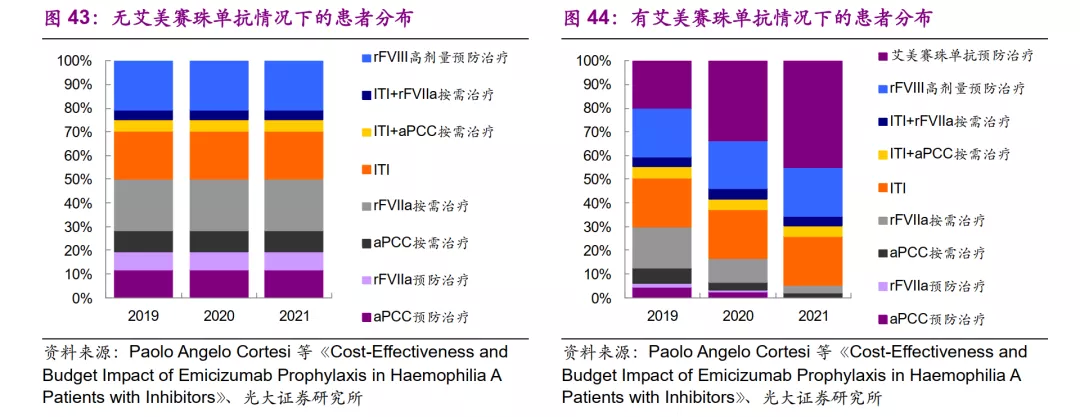
艾美赛珠单抗相比aPCC的ICER为-2126万欧元,相比rFVIIa的ICER为-2527万欧元,具有相当明显的增量成本优势。
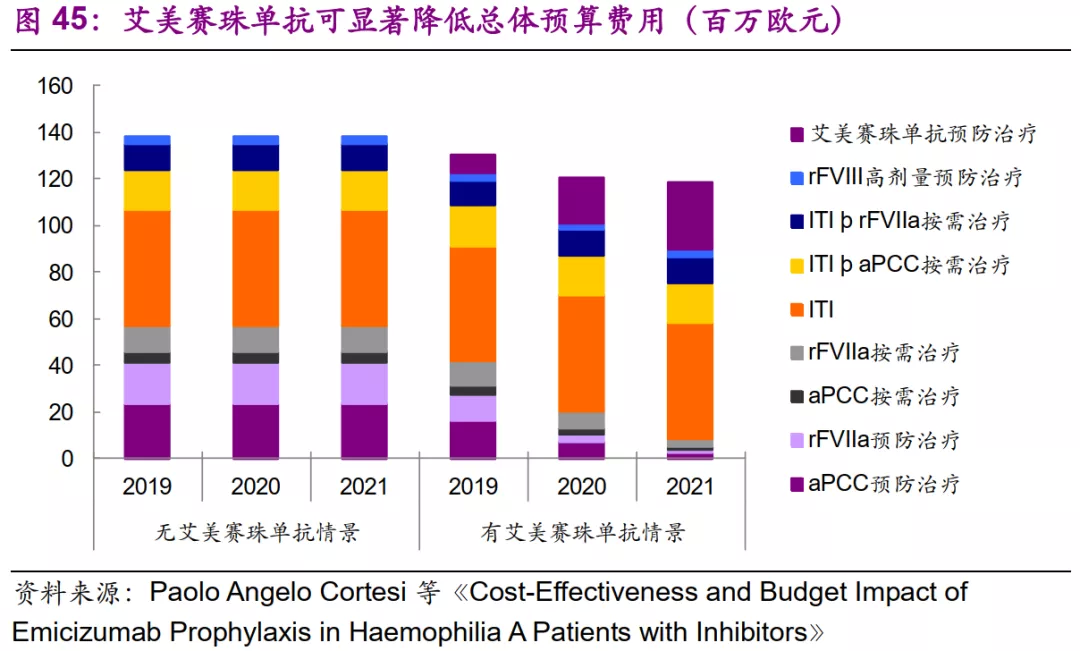
假设意大利有170名有抑制物的HA患者,构建模型进行预算分析,结果显示,在有艾美赛珠单抗的情景中,接受艾美赛珠单抗预防治疗的患者人数从2019年的34名增加到2021年的77名,替代了原有的BPA预防治疗。
在三年模拟中,有艾美赛珠单抗的情景明显降低了预算额度,其中2019年降低800万欧元,2020降低1760万欧元,2021降低1980万欧元;在2019年至2021年的模拟时间内总预算减少了4540万欧元。
综合来看,与aPCC和rFVIIa预防治疗相比,艾美赛珠单抗预防治疗明显节省了成本,并显着降低了总体NHS费用。由于优秀的临床效果,艾美赛珠单抗预防治疗可被视为具有抑制物的HA患者更加经济的治疗方法。
4、创新药产生回报的关键是什么?
4.1、创新药投资回报的关键:收入差距远大于研发投入差距
新药研发成本高昂,Steven M. Paul等人于2010年发表在《Nature Reviews Drug Discovery》上的研究表明,开发一款新药所需时间约为13.5年,研发投入约为8.73亿美元,若考虑资本成本,则成本高达17.78亿美元。而随着新药研发的难度和风险不断上升,该成本仍将持续上涨。
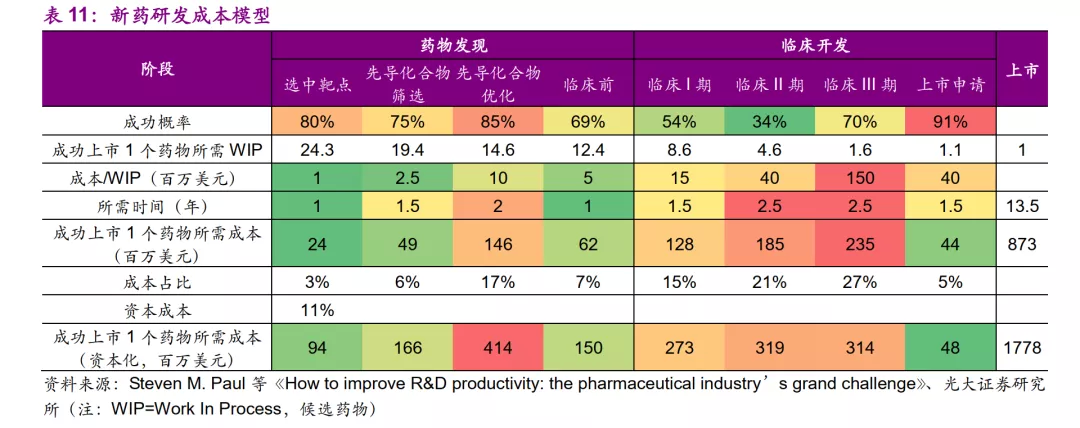
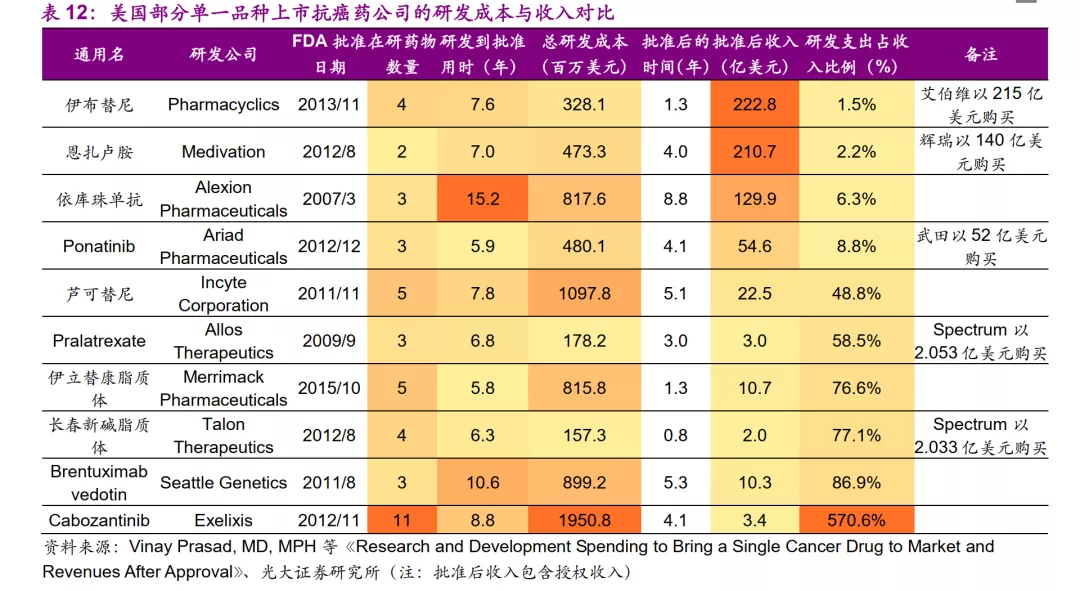
Vinay Prasad 等人发表在《JAMA Internal Medicine》的一篇研究对于10个单一品种的抗癌药公司进行分析发现,一种抗癌药推向市场的成本为6.480亿美元,而且在很短的时间内就可以收回研发成本,有些公司的收入比研发支出高10倍以上。这一罕见的经济现象为创新药投资带来极大的吸引力。
从研发支出占收入比重来看,除Cabozantinib之外,其余药物的研发支出均远小于收入,其中伊布替尼、恩扎卢胺等四个药物甚至低于10%,考虑到创新药净利润率较高,药品上市后数年内即可收回前期研发成本,而且部分药物以对外授权的方式获得授权收入,无需学术推广等其他费用,利润更加可观。
该研究所选取的10种药物研发成本之间的差距虽大(最高是最低的12.4倍,相差17.9亿美元),但其相差程度远远小于批准后收入的差距(最高是最低的109.1倍,相差220.7亿美元),综合来看,上市后收入是决定投入产出比的最关键因素。
4.2、创新药销售收入的核心:临床价值是商业价值的基石
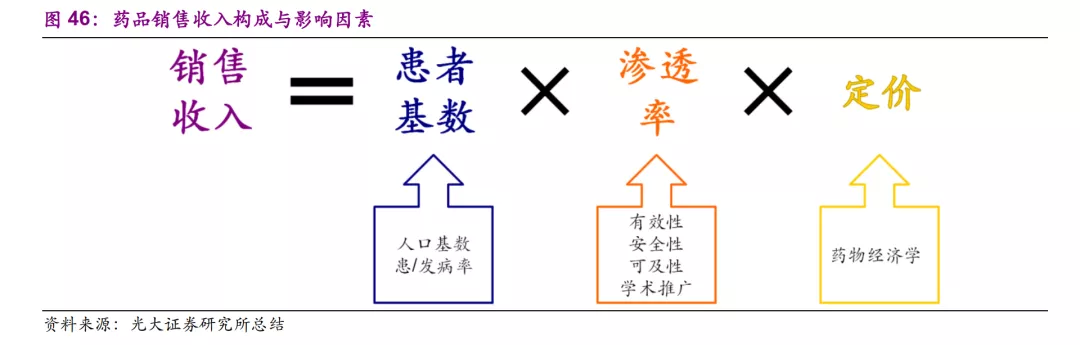
创新药的销售收入主要由三个因素构成:
患者基数:一个药物的适用患者基数主要由人口基数和患病率/发病率所决定,相对较为稳定;
渗透率:在适用患者群体内,一个药物的渗透率则取决于有效性、安全性、可及性和学术推广等因素,其中有效性、安全性的临床价值是实现推广、增加渗透率的前提条件;
定价:随着未来医保谈判逐渐常态化,药物经济学将广泛应用在创新药定价中,而当前国际主流的药物增量成本效果衡量方法也将逐步推广到国内,我们认为未来临床价值将是定价权的关键因素。
综合来看,未来只有实现更高临床价值,方可:
拥有更高的定价权,成为利润率的直接决定因素;
获取临床医患的认可,是临床渗透率的核心驱动力。在高临床价值的基础之上,企业强大的学术推广能力将是迅速提升渗透率、实现高销售额的商业回报的关键。
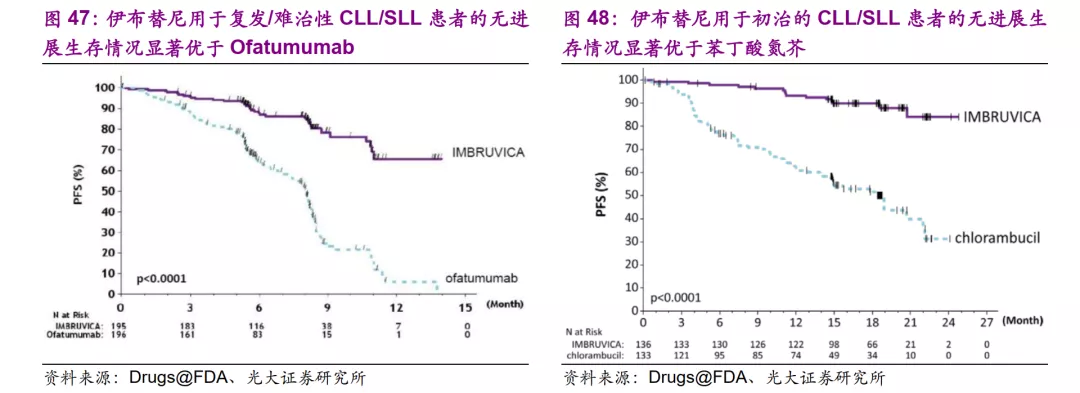
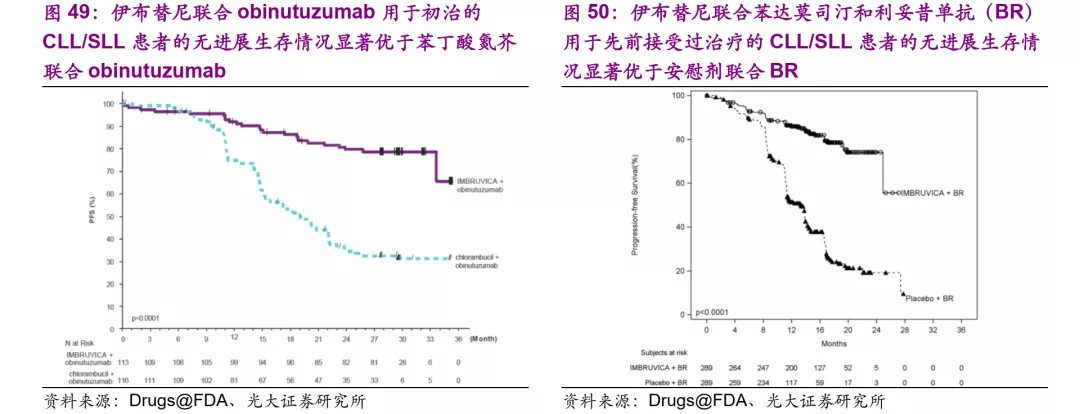
以伊布替尼为例,该药物之所以可以获得巨额回报,除了强生和艾伯维优秀的学术推广能力之外,另一个重要原因在于其实现了非常优秀的临床效果,在CLL/SLL患者(CLL=Chronic lymphocytic leukemia,慢性淋巴细胞性白血病;SLL=Small lymphocytic lymphoma,小淋巴细胞淋巴瘤)从初治到复发/难治,单用和联用的多种治疗方案中屡次击败传统药物如Ofatumumab、苯丁酸氮芥等,实现大幅度临床获益,临床价值成为药品商业价值的基石。
5、创新药定价逻辑的重塑:临床价值为王
根据周仪等研究者在《中国药品价格管理机制历史演变》一文中的总结,我国药品价格管理机制的历史演变阶段可分为:
1.1949-1996年药品价格规制制度整改前阶段
a)1949-1984年,计划经济背景下药品价格完全控制阶段,政府严格管理定价;
b)1984-1996年,药品价格秩序混乱阶段,企业自主定价,药价迅速攀升;
2.1996-2009年药品价格规制制度整改进程
a)1996-1998年,药品价格管制的开创阶段,将倒扣作价改为顺加作价;
b)1998-2000年,药品价格管制进一步完善阶段,放宽新药等药品的销售利润率,而部分普通药品实行优质优价。
c)2000-2009年,多种药品价格管制方法共存阶段,包括药品政府定价、直接价格控制、药品集中招标采购、药品强制降价;
3.2009-2015年新医改
建立科学合理的药品价格形成机制、初步建立国家基本药物制度、建立健全药品供应保障体系、加快推进基本医疗保障制度建设。
4.2015年取消药品最高限价,改为医保控费
国家发改委与国家卫计委、人社部等部门联合发布《关于印发推进药品价格改革意见的通知》,除麻醉药品和第一类精神药品仍暂时由国家发改委实行最高出厂价格和最高零售价格管理外,对其他药品政府定价均予以取消,不再实行最高零售限价管理,按照分类管理原则,通过不同的方式由市场形成价格。其中:
a)医保基金支付的药品,通过制定医保支付标准探索引导药品价格合理形成的机制;
b)专利药品、独家生产药品,通过建立公开透明、多方参与的谈判机制形成价格;
c)医保目录外的血液制品、国家统一采购的预防免疫药品、国家免费艾滋病抗病毒治疗药品和避孕药具,通过招标采购或谈判形成价格。其他原来实行市场调节价的药品,继续由生产经营者依据生产经营成本和市场供求情况,自主制定价格。
2015年的《通知》成为创新药价格谈判机制的纲领性文件,近年来数次医保谈判则促进了药物经济学方法论在实际应用中的不断成熟,国内创新药正处于重塑定价逻辑的历史阶段。
根据当前国际主流的增量成本效果的计算公式:
ICER=△C/△Q
若一个新药想要在价格谈判中占据优势,则需要尽可能降低相对现有主流治疗方案的ICER,可采取的途径无非两种:
1)降低△C:即降价;
2)提高△Q:即提升临床价值,帮助患者实现更好的QALY。
在全新的定价逻辑下,若要避免在价格谈判中的大幅度降价,则唯有提升相对现有疗法的临床获益,可行的发展路线则有3种:
(1)First/Best-In-Class:真正的创新形成垄断
对于First/Best-in-Class类创新药,若能够凭借专利或者技术壁垒等优势实现长期、不可替代的、相对现有疗法有明显改善的临床价值,做到“Only-in-Class”的垄断,也就是长期维持最高的△Q,进而可以拥有最高的△C空间,即更高的价格谈判空间。
(2)First-Follow:更快的速度抢食红利
对于me-too类创新药,由于临床价值相似,△Q相近,降低ICER仅剩降低△C,即降价一条路可走,直接竞争对手越多,越会面临惨烈的价格战。对于这一类创新药,可选的策略唯有实现First-Follow,即在同类药物中第一个上市,获得时间窗口红利,减少同期谈判竞争对手的数量,进度领先越多,则拥有越大的时间窗。
(3)创新国际化:最广的范围变现研发
由于国内的创新药研发竞争激烈,且患者支付能力有限,若要实现一个药物分子的商业价值最大化,则应当考虑开拓国际市场,包括对外授权、开展国际多中心临床然后在其他国家和地区申报上市等,将药物临床价值在尽可能多的市场中变现为商业价值。
6、风险分析
(1)创新药研发失败或不达预期的风险
由于新药研发风险高,若有效性不足或毒性过大则有可能导致项目研发失败;若试验推进速度或审批进度较慢,则有可能导致上市时间慢于预期。
(2)药品降价超预期的风险
创新药竞争日益加剧,在未来的医保谈判中,有可能出现竞价激烈、降价超预期的风险。
(3)销售收入不达预期的风险
由于创新药的创新性较强,上市后的销售需要大量学术推广工作进行市场导入,有可能会出现销售收入不达预期的风险。(编辑:孟哲)




 扫码下载智通APP
扫码下载智通APP