新股消息 | 欧康维视通过港交所聆讯 港股未盈利生物医药公司再添一家
智通财经APP获悉,据港交所6月21日披露, 欧康维视生物(Ocumension
Therapeutics-B)通过港交所聆讯,摩根士丹利和高盛担任其联席保荐人。
欧康维视是一家中国眼科医药平台公司,致力于识别、开发和商业化同类首创或同类最佳的眼科疗法。
公司的股东由全球及中国顶尖机构投资者及专注生物技术的投资基金组成,其中包括6 Dimensions、Boyu、淡马锡、General Atlantic、斯道资本、3W Partners及Cormorant Asset Management。
根据弗若斯特沙利文的资料,中国眼科医药市场预计由2019年的人民币194亿元增至2024年的人民币408亿元,复合年增长率为16.0%。
公司的产品组合中有16种药物资产,涵盖所有主要的眼睛前部及后部疾病。公司有四种创新候选药物正在中国处于后期开发阶段。公司的产品组合包括自2015年以来获美国食品药品监督管理局(或FDA)批准但未以任何剂型在中国上市的十种眼科药物中的三种。此外,公司的产品组合包括三种处于或临近商业化阶段的药物。
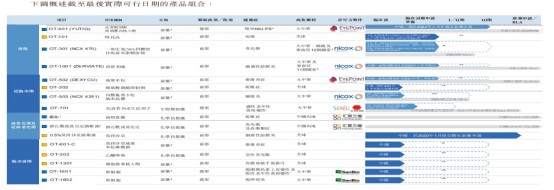
核心产品
OT-401(YUTIQ)是公司的核心产品,是一种创新玻璃体内植入剂,旨在通过36个月的单次给药持续释放皮质类固醇活性成分来治疗累及眼后段的慢性非感染性葡萄膜炎,或慢性NIU-PS(一种在中国尚无治疗标准的适应症)。
在美国,YUTIQ是首款且唯一经FDA批准可释放氟轻松长达36个月的葡萄膜炎疗法。在中国及全球,葡萄膜炎是造成失明的主要原因之一。
根据弗若斯特沙利文的资料,鉴于(i)在全球范围内仅有三种市售的类固醇植入物适用于慢性NIU-PS,且目前在中国该等植入物均尚未用于葡萄膜炎患者的治疗;及(ii)OT-401是中国唯一正在进行III期临床试验评估的类固醇植入物,预期获批准后OT-401将为中国用于治疗慢性NIU-PS的首款及唯一眼部植入剂。此外,OT-401已获批准用于治疗博鳌试验计划中的患者,且自2019年8月起开始为公司产生有限收益。OT-401的中国专利将于2024年10月到期。
公司于2019年11月在中国启动桥接III期试验,并招募首位患者。公司计划于2022年上半年提交新药申请,获批准后于2022年下半年开始商业化。
主要客户
于往绩记录期,公司仅有一名客户,为博鳌超级医院的指定采购代理,患者在该医院接受YUTIQ治疗。利用可在中国为满足紧急医疗需求而进口尚未经过批准的国外药物的有利政策,公司将OT-401(YUTIQ)出售予海南省博鳌先行区的此名客户。
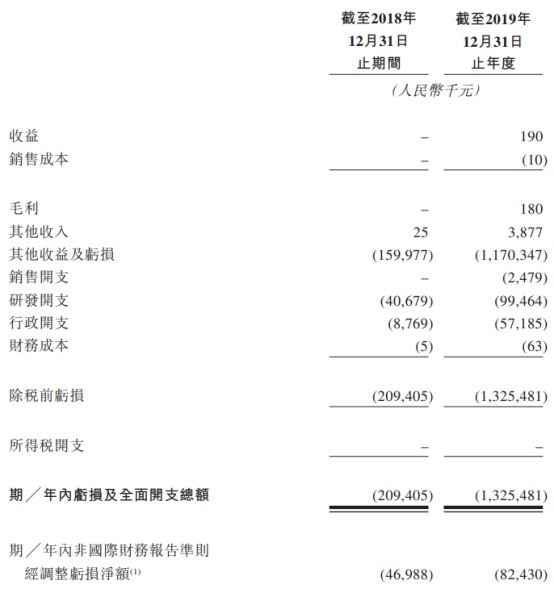
主要财务数据
公司2018年未实现收入,2019年仅实现收入约19万元人民币。
公司的亏损及全面开支总额由2018年的人民币2.09亿元增加至2019年的人民币13.25亿元。亏损净额增加主要由于按公平值计入损益的金融负债公平值亏损因发行优先股及购股权及公司估值等而增加人民币10.36亿元。
于往绩记录期,公司的营运产生负现金流量净额,主要由于公司的研发开支所致。于往绩记录期,公司依赖股权融资作为主要流动资金来源。
公司预期通过推出商业化产品,如公司于2020年4月及2020年3月先后推出欧沁及酒石酸溴莫尼定滴眼液,将自营运产生更多现金流量。
公司有充足的营运资金以承担自本文件日期起计至少未来12个月的至少125%成本,包括研发开支、业务发展及市场推广开支、行政及运营成本。

近期发展
于2020年1月,公司与EyePoint就DEXYCU订立一项独家许可协议。于2020年3月,公司与Sanbio就开发及商业化OT-1601及OT-1602订立合作及许可协议。而且,公司于2020年1月向国家药品监督管理局提交0.5%莫西沙星滴眼液的简化新药申请,预计将于2021年上半年获批准。公司于2020年2月与汇恩兰德就酒石酸溴莫尼定滴眼液订立独家销售协议,公司已分别于2020年3月及4月推出酒石酸溴莫尼定滴眼液及欧沁。此外,公司已为OT-401的III期桥接临床试验招募29名患者。于2020年1月,公司专用的眼科制药生产设施也已在江苏省苏州市破土动工。
风险因素
公司的主要风险因素包括:
公司自成立以来已产生重大经营亏损,于可见未来或会继续产生经营亏损,也可能始终无法盈利;开发及商业化候选药物的权利部分受限于许可方伙伴授予公司的许可的条款及条件;预计将依赖第三方(包括许可方伙伴)供应候选药物或原材料来生产公司的未来获批药物;公司可能无法成功完成临床试验、取得监管批准及实现候选药物商业化,或在上述事项出现重大延迟;公司的未来获批药物可能无法获得商业成功所需的来自医生、患者、第三方付款人及医学界其他各方的市场认可度。
募资用途
据招股书,公司募集资金的主要用途是:
将用于公司的核心产品OT-401;用于其他候选药物;将用于根据公司与当地政府所订合作协议收购苏州的制造设施;将用作营运资金及用于其他一般公司用途。



 扫码下载智通APP
扫码下载智通APP