新股消息丨临床后期生物制药公司云顶新耀申请港股上市
智通财经APP获悉,据港交所7月19日披露,云顶新耀申请在港交所主板上市,高盛和美国银行证券(BofA Securities)为联席保荐人。
云顶新耀是一家临床后期生物制药公司,业务包括全球同类首创或同类最佳疗法的许用、临床开发及商业化,以解决大中华及亚太区其他新兴市场尚未得到满足的医疗需要。
自该公司于2017年创立以来,已创立一个有高度扩展性的平台、组建一支经验丰富及远见卓识的管理团队,并已打造一个由八款极具前景的临床候选药物组成的产品组合,有关药物覆盖肿瘤、免疫学、心肾疾病及感染性疾病。该公司以该四个治疗领域为目标乃基于该领域有大量未得到满足的医疗需要、患者人数众多,以及全球可用的创新产品。
该公司在欧美四个城市设有见识广阔及经验丰富的业务开发团队,其已与全球的生物制药公司建立强大的关系,并有系统地在各重点治疗领域中筛选及评估具差异化、处于后期、已规避风险,且相信在大中华及其他亚太新兴市场有重大商业潜力的资产。严谨及主动地识别及选择新增候选药物是该公司增长策略的中心。
该公司立志成为顶尖的生物制药公司,专注于开发及商业化全球创新疗法,并以大中华及亚太区其他市场为起点。
下表显示了该公司的产品管线:
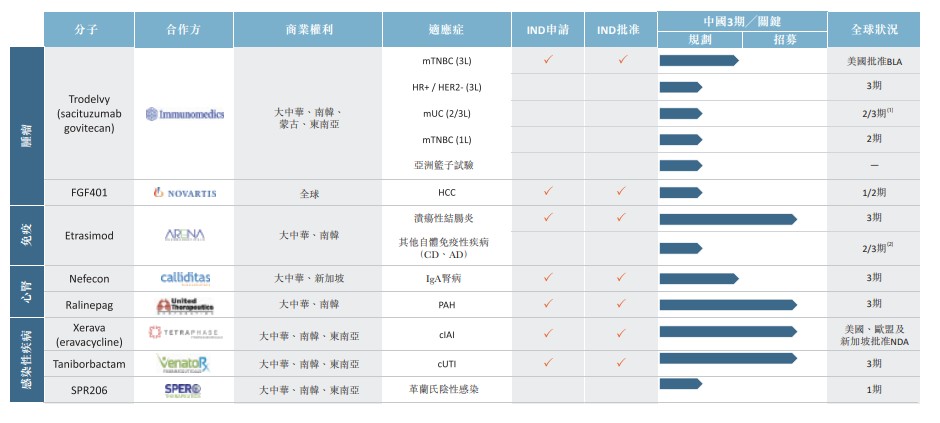
该公司在肿瘤科的支柱资产为sacituzumab govitecan (Trodelvy),其为同类首创的TROP-2靶向抗体药物偶联物(ADC)。TROP-2是一种膜抗原,在许多常见的上皮癌中过度表达。根据弗若斯特沙利文报告,存在TROP-2过度表达的癌症的总新发病例数超过350万起,占2019年中国全部440万起癌症新发病个案超过78.9%,因此,sacituzumab govitecan可能具有广谱的抗肿瘤效果。
该公司与许用伙伴Immunomedics, Inc.(IMMU.US)或Immunomedics最初开发sacituzumab govitecan 乃为治疗乳腺癌及尿路上皮细胞癌。于2020年4月,基于客观缓解率(33.3%)及无进展生存期(5.5个月),sacituzumab govitecan获美国FDA加速审批可用于治疗过往至少已接受两线转移性疾病治疗的转移性三阴性乳腺癌(mTNBC)患者。于2020年7月,Immunomedics宣布ASCENT研究(一个3期、随机、确认性试验)取得阳性结果,在过往已就转移性疾病接受最少两线治疗的mTNBC患者身上,sacituzumab govitecan大幅提升其无进展生存期(PFS)、总生存期(OS) 及客观缓解率(ORR)。
该公司于2020年4月在中国就sacituzumab govitecan作为mTNBC三线治疗的临床试验取得国家药监局的IND批准。于2020年及2021年,该公司预期会开展mTNBC三线治疗桥接注册性试验、HR+/HER2-mBC三线治疗注册性试验、转移性尿路上皮细胞癌二/三线治疗注册性试验,以及亚洲篮子研究,当中包括具有高TROP-2表达的多种癌症类型的病患。
该公司在感染性疾病方面的支柱资产及核心候选产品之一为eravacycline (Xerava),是一种潜在同类最佳新型全合成静脉给药的四环素类药物,通过与30S核糖体亚基结合来阻止细菌蛋白质的合成。Eravacycline对有多种耐药性(MDR)的及常见于中国的革兰氏阴性病原体(如肠桿菌目及鲍曼不动桿菌)展现出广泛及强大的体外抑制作用。
根据弗若斯特沙利文报告,革兰氏阴性MDR抗生素市场为中国感染性疾病增长速度最快的市场之一,2019年的市场规模达人民币205亿元;预期于2024年时将扩大至人民币351亿元,并于2030年时扩大至人民币557亿元,2019年至2024年的复合年增长率为11.4%,而2024年至2030年的复合年增长率为8.0%。
Eravacycline (Xerava)目前于美国及欧盟获批准用于治疗复杂性腹腔内感染(cIAI)。该公司许用伙伴Tetraphase Pharmaceuticals, Inc.(TTPH.US)或Tetraphase已于2009年至2018年间在美国完成了21项eravacycline临床试验(受试者超过2700人)。在该研究中,eravacycline对由革兰氏阳性及革兰氏阴性病原体(包括耐药菌株)而受感染的患者展现出高临床治愈率。Eravacycline 于2020年4月收到新加坡卫生科学局的NDA批准用于治疗cIAI,新加坡为该公司拥有eravacycline独家商业权的地区之一。该公司已于中国完成1期PK桥接试验,并正于中国进行cIAI的3期註册性试验,用于支持中国的注册申请。
该公司在免疫学方面的支柱资产及核心候选产品之一为etrasimod,是一种潜在同类最佳的第二代1-磷酸鞘氨醇受体(S1PR)1、4及5口服调节剂。etrasimod最初的适应症为溃疡性结肠炎(UC),但其后发现有机会适用于克隆氏症(CD)及自体免疫性皮肤病(如异位性皮肤炎),该类疾病过往在中国被漏诊及治疗不足。
根据弗若斯特沙利文报告,自体免疫性疾病于2019年在中国的市场规模达人民币162亿元;预期于2024年时将扩大至人民币532亿元,复合年增长率为26.8%。
Etrasimod的耐受性良好,并在该公司许用伙伴Arena Pharmaceuticals, Inc. (ARN.US)或Arena Pharmaceuticals于弥患中度至严重UC的患者身上进行的随机双盲2b期临床试验中达到预定的疗效终点。由于etrasimod为口服,且与注射式生物制剂(现时的治疗标准)的临床疗效相若,其已作好准备成为中国中度至严重UC的首选治疗方法。该公司已于中国完成1期PK桥接试验,并正于中国大陆、韩国及中国台湾进行UC的3期注册性试验。
该公司在心肾疾病方面的支柱资产为Nefecon,是一种潜在首创用于治疗IgA肾病(IgAN)的候选药物,IgAN是中国肾小球肾炎和慢性肾病的常见病因。即使得到治疗,约50%的IgAN患者会于30年内发展至末期肾病(ESRD)。
根据弗若斯特沙利文报告,2019年中国有218万名IgAN病患。Nefecon是布地奈德的口服靶向释放製剂,而布地奈德是一种安全性和功效已得到验证的强效糖皮质激素受体。
Nefecon的创新制剂让布地奈德可靶血递送至小肠中产生异常IgA抗体的部位,有助提升疗效及降低与全身使用布地奈德相关的副作用。在该公司许用伙伴Calliditas Therapeutics AB(CALT.US)或Calliditas进行的随机双盲2b期临床试验中,Nefecon在降低蛋白尿水平及eGFR稳定度方面具有统计意义。该公司于2019年就Nefecon用于IgAN取得IND批准,并计划与Calliditas合作加入全球3期注册性试验。
财务状况
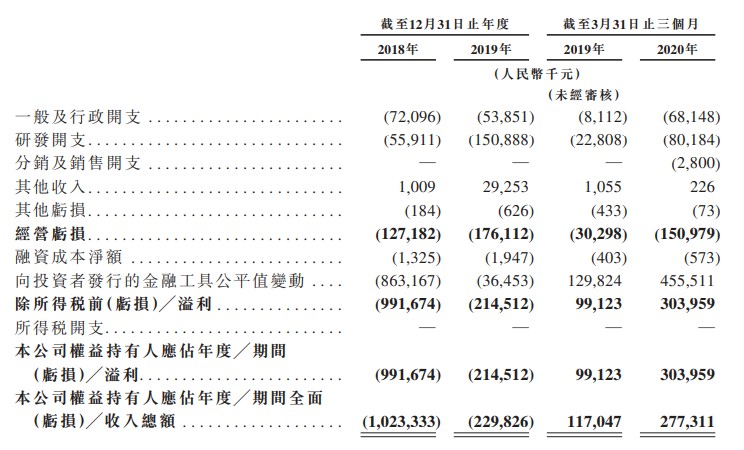
截至2018年及2019年12月31日止年度以及截至2020年3月31日止三个月,该公司尚未产生任何收益,且预计从产品销售中不会产生任何收益,除非及直至现有或未来候选药物中的一种药物获得监管批准及商业化为止,且该公司已产生经营亏损净额。
截至2018年及2019年12月31日止年度以及截至2019年及2020年3月31日止三个月,该公司经营亏损净额分别为人民币1.272亿元、人民币1.761亿元、人民币3030万元及人民币1.51亿元,绝大部分经营亏损因研发开支以及一般及行政开支而产生。
其他收入主要包括(i)终止与天境生物合作协议的收益及(ii)主要向EverestII(在与EverestII合并前)及其他人士(包括关联方)提供有关业务发展、临床开发、相关平台支持及一般及行政支持方面的顾问服务收入净额。
截至2018年12月31日止年度及截至2019年12月31日止年度,该公司分别录得向投资者发行的金融工具公平值变动产生的亏损人民币8.632亿元及人民币3650万元,而截至2019年及2020年3月31日止三个月则分别录得收益人民币1.298亿元及人民币4.555亿元。向投资者发行的金融工具主要包括可赎回及可换股优先股、认股权证负债及可换股票据。
由于持续开发及寻求对候选药物的监管批准,并开始将任何获批产品商业化,该公司预计在可预见的未来将持续产生亏损,且预计经营亏损将会增加。另外上市后,该公司预计作为公众公司将产生与营运有关的成本,预计财务表现将会随着季度及年度波动,乃由于候选药物的开发状况,为获得监管批准及候选药物商业化付出的努力所致。
2020年6月,该公司完成C-2轮融资,筹集约2.60亿美元。C-2轮由Janchor Partners Limited牵头,由RA Capital Management L.P.及高瓴资本连同其他风险投资及私募股权基金以及投资控股公司联合牵头。



 扫码下载智通APP
扫码下载智通APP