接种55天后仍能防护肺部感染,辉瑞(PFE.US)和BioNTech SE(BNTX.US)疫苗公布临床前结果
本文源自微信公众号“药明康德”。
今日,辉瑞(PFE.US)和BioNTech SE(BNTX.US)公司公布了双方联合开发的候选疫苗BNT162b2在小鼠和非人灵长类动物模型中的初步结果。BNT162b2是一款核苷修饰的mRNA疫苗。临床前研究结果显示,BNT162b2在恒河猴模型中能够在疫苗接种55天后的攻毒实验中,成功防护病毒的肺部感染。这款候选疫苗目前正在2/3期临床试验中接受检验。临床前数据发表在预印本网站bioRxiv上,并且正在接受同行评议。

BNT162b2疫苗的设计
BNT162b2是一款经过核苷修饰和密码子优化的mRNA疫苗。核苷修饰能够降低mRNA本身的免疫原性,而密码子优化可以提高蛋白表达的水平。BNT162b2编码的是具有融合前构象的病毒刺突蛋白。对BNT162b2表达的刺突蛋白的立体结构解析显示,在有些刺突蛋白中,3个抗体结合域(RBD)里有一个RBD呈现“上位”构象,这种RBD构象能够显露更多RBD与ACE2受体结合的表位,有利于激发产生中和效应的抗体。BNT162b2表达的刺突蛋白中呈现这种构象的刺突蛋白占20%。
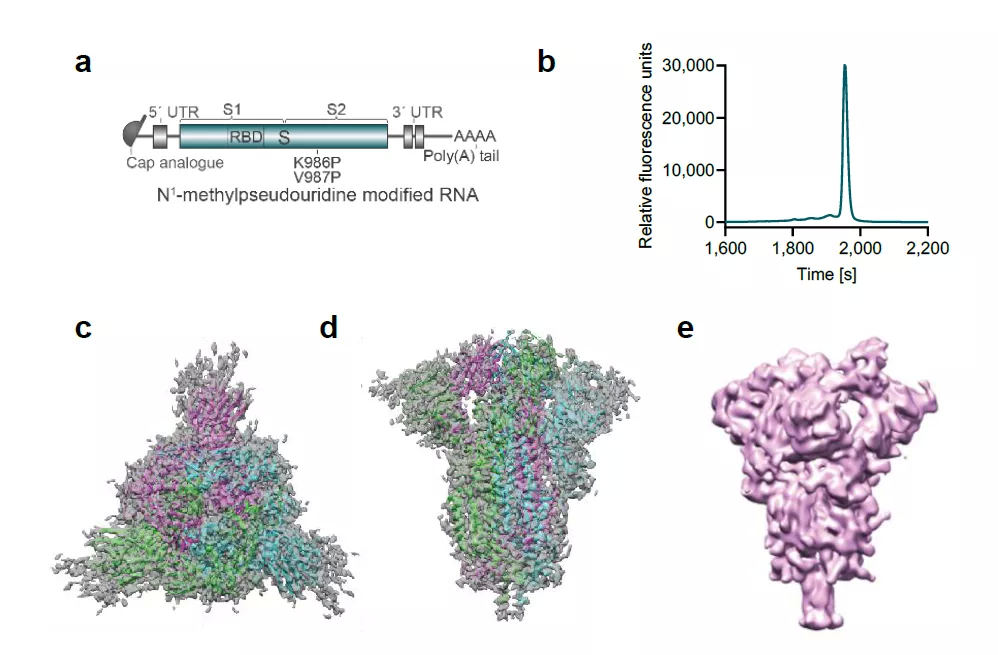
▲BNT162b2的设计(a)以及表达的刺突蛋白的3D结构(c,d,e)(图片来源:参考资料[1])
疫苗激发的中和抗体反应
研究人员在小鼠模型和恒河猴模型中检验了这款疫苗激发的抗体和T细胞免疫反应。在恒河猴模型中,相隔21天,接受两剂肌肉注射的BNT162b2之后,动物体内的刺突蛋白特异性IgG抗体水平和病毒中和抗体滴度显著升高。使用表达荧光蛋白的病毒株(USA_WA1/2020)进行检测,接受剂量为30 µg和100 µg的BNT162b2疫苗接种的恒河猴体内的中和抗体几何平均滴度(GMT)峰值分别达到962和1689。在第一次疫苗接种后第56天,中和抗体GMT仍然维持在285(30 µg剂量)和310(100 µg剂量)。与之相比,人类康复血清的中和抗体GMT为94。
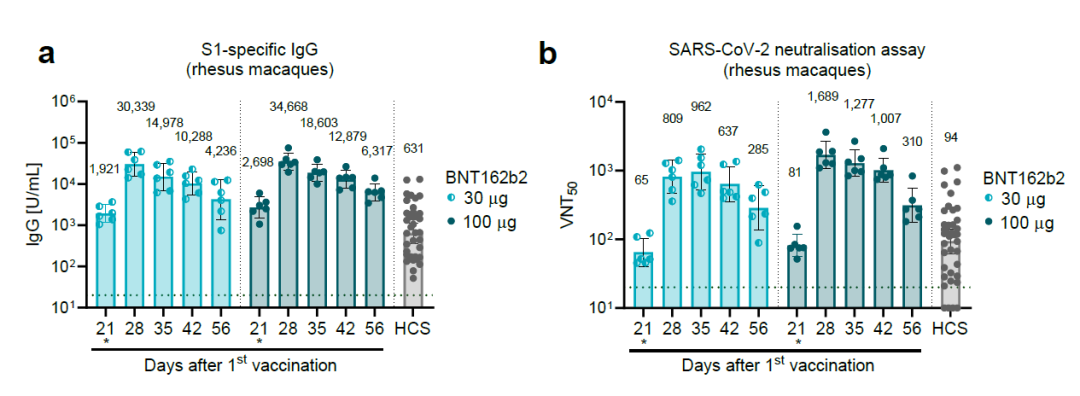
▲BNT162b2激发的刺突蛋白特异性IgG水平(a)和中和抗体滴度(b)(图片来源:参考资料[1])
疫苗激发的T细胞免疫反应
研究人员同时发现,BNT162b2疫苗在激发强力的IFNγ反应的同时,几乎没有激发IL-4反应。细胞内细胞因子染色(ICS)检测结果显示,BNT162b2显著提高产生IFNγ,IL-2,和TNF的CD4阳性T细胞数目,然而产生IL-4的CD4阳性T细胞数目几乎没有增加。这些结果表明,BNT162b2能够激发有助于维持长久免疫反应的Th1反应。BNT162b2同时提高产生IFNγ的刺突蛋白特异性CD8阳性T细胞的数目。

▲BNT162b2提高产生IFNγ的CD4阳性(a)和CD8阳性T细胞(b)数目(图片来源:参考资料[1])
恒河猴模型攻毒实验结果
为了检测BNT162b2防护病毒感染的效果,研究人员在恒河猴接种第二剂疫苗55天之后,对它们进行了攻毒实验。实验结果显示,接种生理盐水的3只恒河猴中,2只在接受病毒挑战3天后肺泡灌洗液(BAL)中检测到病毒的RNA,1只在接受病毒挑战6天后BAL中检测到病毒的RNA。而接种BNT162b2的6只恒河猴中,没有一只动物在BAL中检测到病毒的RNA。
在鼻拭子和咽拭子样本中,接种BNT162b2的恒河猴只在接受病毒挑战后第一天检测到病毒RNA,在第三天时病毒RNA水平已经无法检测到。

▲攻毒实验中肺泡灌洗液(a)和鼻拭子(b)样本中的病毒RNA水平(图片来源:参考资料[1])
“这些临床前研究数据与目前我们收集的临床数据相结合,继续支持基于mRNA的疫苗开发项目的前景和合理性。我们相信它有潜力预防上百万COVID-19病例的发生,”辉瑞高级副总裁兼疫苗研发负责人Kathrin U. Jansen博士说。
(编辑:宇硕)



 扫码下载智通APP
扫码下载智通APP