干货!辉瑞(PFE.US)介绍研发管线和卫生事件疫苗研发最新动态
本文来自微信公众号“药明康德”,文中观点不代表智通财经观点.
9月14日和15日,辉瑞公司(PFE.US)举办了为期两天的线上投资者日活动(Investor Day)。自从COVID-19卫生事件爆发以来,辉瑞公司和BioNTech(BNTX.US)公司联合开发的候选疫苗BNT162b2的研发进展吸引了大量的关注。在投资者日活动上,辉瑞公司也公布了该公司在COVID-19研发领域的最新动向。此外,辉瑞公司的高管还介绍了该公司在肿瘤学、免疫学/炎症、罕见病、心血管和代谢疾病、以及疫苗领域的研发管线。
辉瑞近几年来对公司的架构进行了大规模的重组,致力于专注新药开发和提高研发效率。辉瑞首席执行官Albert Bourla先生表示,辉瑞的最终目标是通过更多突破性研究改变患者的生活。今天药明康德内容团队将与读者分享辉瑞投资者日的精彩内容。
肿瘤学研发管线
去年,辉瑞通过收购Array公司,大幅度扩展了其肿瘤学研发管线。其中,BRAF抑制剂Braftovi(encorafenib)联合EGFR抑制剂西妥昔单抗(cetuximab,英文商品名为Erbitux)已经在今年4月获得FDA批准,治疗携带BRAF V600E突变的经治转移性结直肠癌(CRC)成人患者。
在今日的报告中,辉瑞介绍了encorafenib与MEK抑制剂binimetinib,和cetuximab构成的3联疗法,一线治疗转移性CRC患者的2期临床试验结果。试验结果显示,三联疗法在携带BRAF V600E突变的初治转移性CRC患者中达到50%的客观缓解率(ORR)和85%的疾病控制率。辉瑞计划在今年晚些时候启动3期临床试验。
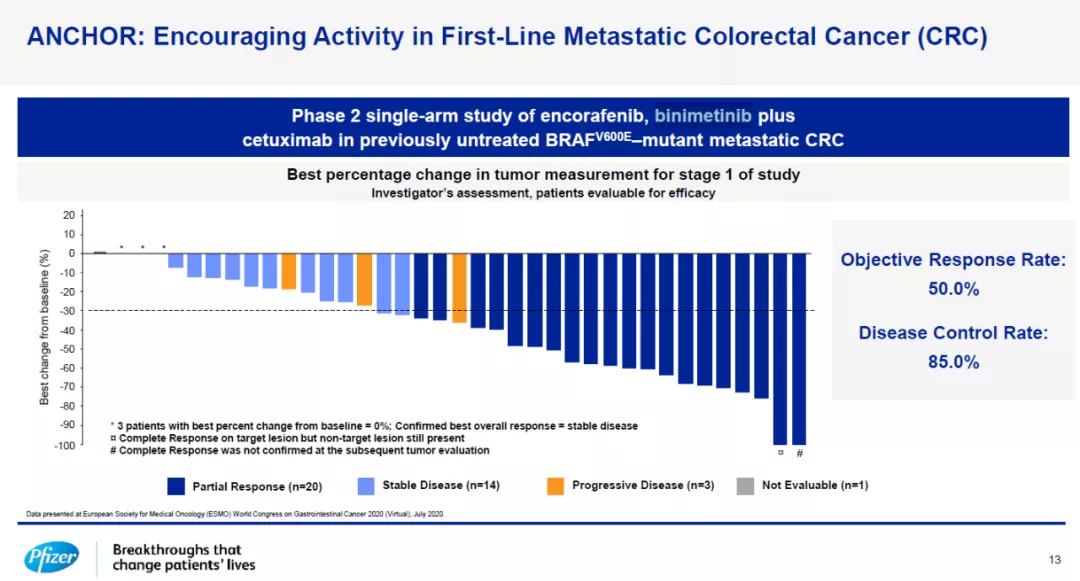
Encorafenib/binimetinib/cetuximab 3联疗法一线治疗CRC患者的2期临床结果
在早期研发管线中,辉瑞介绍了一款新一代靶向HER2的抗体偶联药物(ADC)PF-06804103。这款ADC能够将具有细胞渗透性的细胞毒素auristatin通过高度稳定的连接子连接到抗体的特定位点。在1期临床试验中,它在治疗对靶向HER2的抗体偶联药物ado-trastuzumab emtansine产生耐药性的HER2+乳腺癌患者时表现出可喜的疗效。在2期临床试验推荐剂量时达到71%的客观缓解率。临床前研究显示这款新一代ADC能够在治疗HER2+乳腺癌以外,在治疗HER2低表达乳腺癌和非小细胞肺癌患者时也能产生疗效。
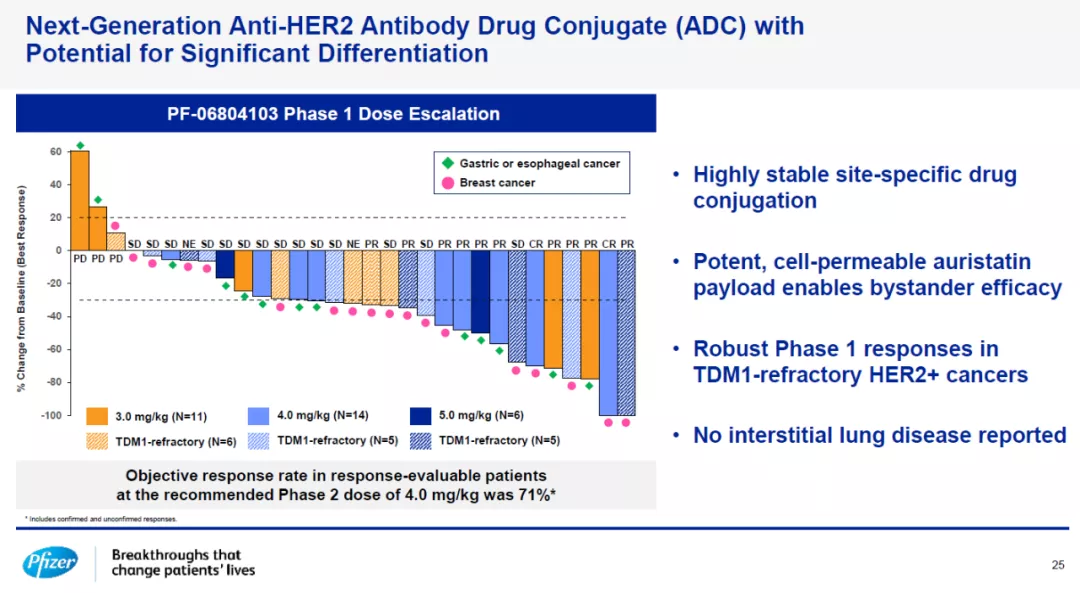
辉瑞新一代靶向HER2的抗体偶联药物1期临床结果
在治疗多发性骨髓瘤方面,辉瑞正在开发一款靶向B细胞成熟抗原(BCMA)的双特异性抗体。它能够与BCMA抗原和T细胞表面的CD3抗原以高亲和力结合,具有强力的肿瘤细胞毒性。在早期临床试验中,这一双特异性抗体达到75%的ORR,其中完全缓解率在多个剂量组达到30%。值得一提的是,即使有些患者已经接受过BCMA抗体偶联药物和靶向BCMA的CAR-T疗法的治疗,他们仍然可以对这一疗法产生应答。

BCMAxCD3双特异性抗体简介
免疫学和炎症研发管线
促进炎症的细胞因子介导多种自身免疫性疾病和炎症性疾病的病理发生,而JAK家族蛋白在介导细胞因子信号传导方面起到关键性的作用。辉瑞在这一领域的研发策略之一是针对特定疾病的病理特征,开发具有独特选择性的抑制剂。
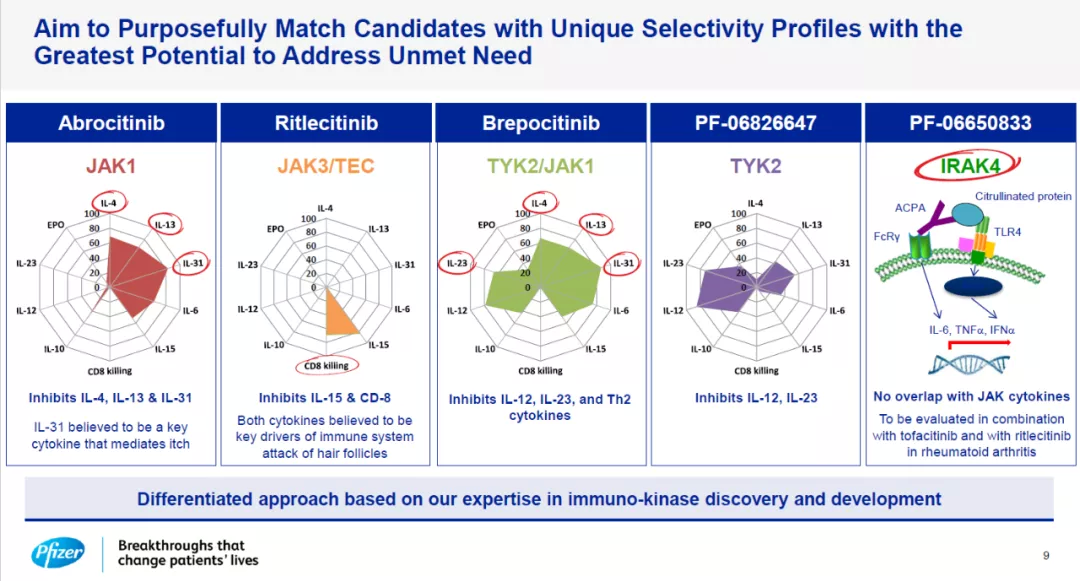
辉瑞开发的多款特异性抑制剂简介
例如,该公司开发的ritlecitinib是一款JAK3/TEC抑制剂,它能够抑制IL-15和CD-8细胞因子的信号传导,而这两款细胞因子是驱动免疫系统杀伤毛囊细胞的重要因素。Ritlecitinib在治疗斑秃患者的2期临床试验中展现出可喜的疗效,已经获得FDA授予的突破性疗法认定,关键性3期临床结果有望在明年第三季度获得。
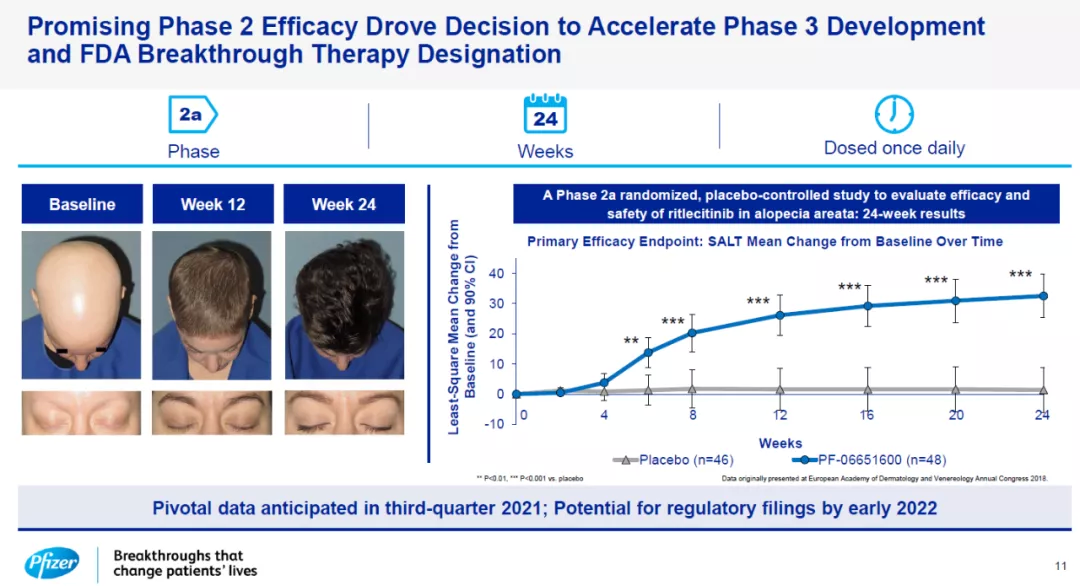
Ritlecitinib的2a期临床结果
辉瑞开发的brepocitinib是一款JAK1和TYK2特异性抑制剂,它能够同时靶向影响特应性皮炎的两条信号通路。在2a期临床试验中,这款外用药物的3%剂量组在接受治疗6周后,41.7%的轻中度特异性皮炎患者达到EASI-90标准(皮肤症状缓解90%以上)。
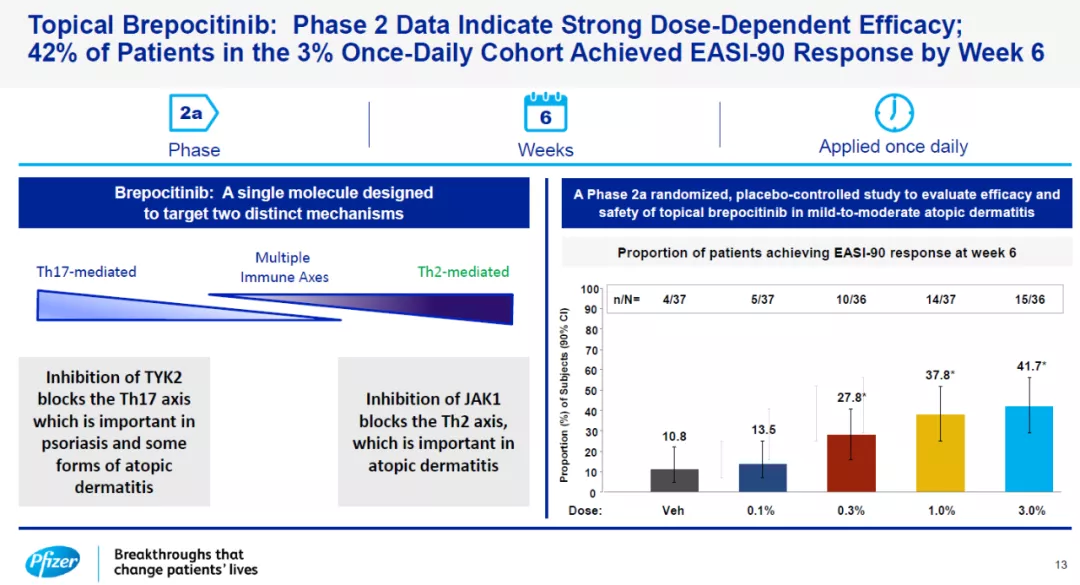
Brepocitinib的2a期临床结果
此外,该公司开发的口服JAK1抑制剂abrocitinib已经完成3期临床试验并且向FDA递交了新药申请,有望在明年获批成为治疗中重度特应性皮炎患者的新选择。
心血管和代谢类疾病研发管线
辉瑞的内科医学部(Internal Medicine)负责开发治疗心血管和代谢类疾病的创新疗法。这一领域的多种慢性疾病波及的患者人数众多,其中心血管疾病是导致死亡的首要原因之一,2型糖尿病和肥胖症已经在全球范围内成为流行病,非酒精性脂肪性肝炎(NASH)不但可能提高肝功能衰竭、心血管事件等严重后果的风险,而且目前没有获批疗法。
辉瑞的研发策略旨在针对人体新陈代谢的不良状态,这一不良状态可能是导致多种慢性疾病的重要因素。
在降低心血管疾病风险方面,辉瑞与Ionis公司旗下Akcea公司联合开发的vupanorsen是一款靶向ANGPTL3的反义寡核苷酸疗法(ASO)。ANGPTL3是一个经过人类遗传学验证的靶点。它在调节甘油三酯和低密度脂蛋白胆固醇(LDL-C)方面具有重要的作用。低水平的ANGPTL3与心血管疾病风险降低相关。
Vupanorsen在2期临床试验中显著降低患者的甘油三酯水平,达到了试验的主要终点。同时它还能够剂量依赖性地降低总胆固醇、非高密度脂蛋白胆固醇等其它不良血脂指标。
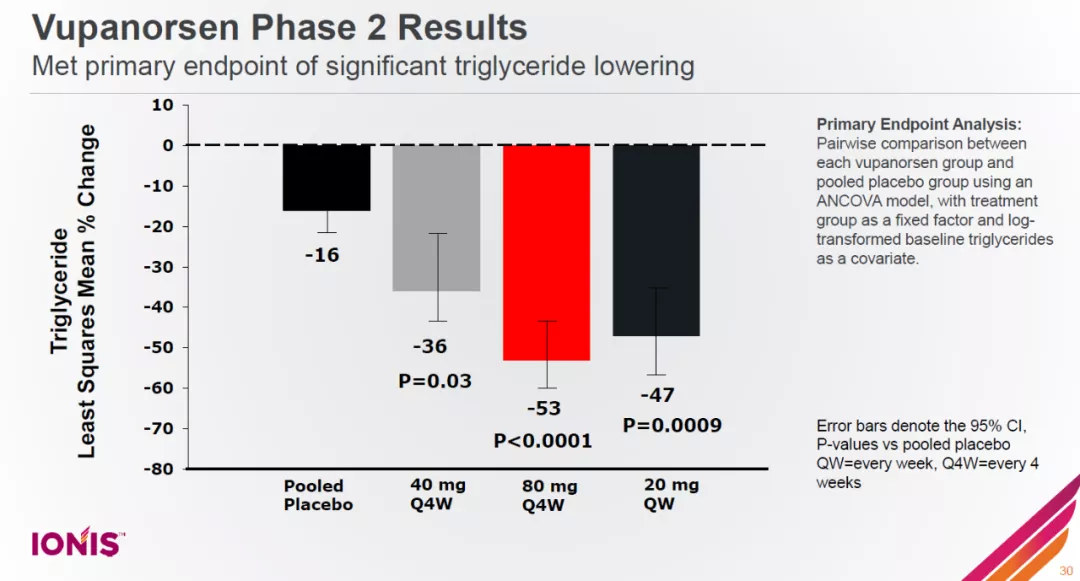
Vupanorsen在2期临床试验中显著降低患者的甘油三酯水平
辉瑞将在今年第三季度启动2b期临床试验,在接受他汀类药物治疗后血脂指标仍然不能得到有效控制的患者中探索vupanorsen的最佳用药剂量。该公司的目标是不但用它来治疗严重高甘油三酯血症患者,还将用它作为降低心血管疾病风险的疗法。
在治疗NASH方面,辉瑞开发的乙酰辅酶A-羧化酶(ACC)的抑制剂clesacostat,和二酰基甘油O-酰基转移酶2(DGAT2)抑制剂ervigastat靶向肝脏合成甘油三酯步骤中的关键蛋白酶。在2a期临床试验中,clesacostat与ervigastat联用,将患者肝脏脂肪水平降低40%,同时限制了因为抑制ACC活性导致的血清甘油三酯水平升高。辉瑞认为,这两款创新疗法的组合可能成为“first-in-class”或“best-in-class”的NASH疗法。
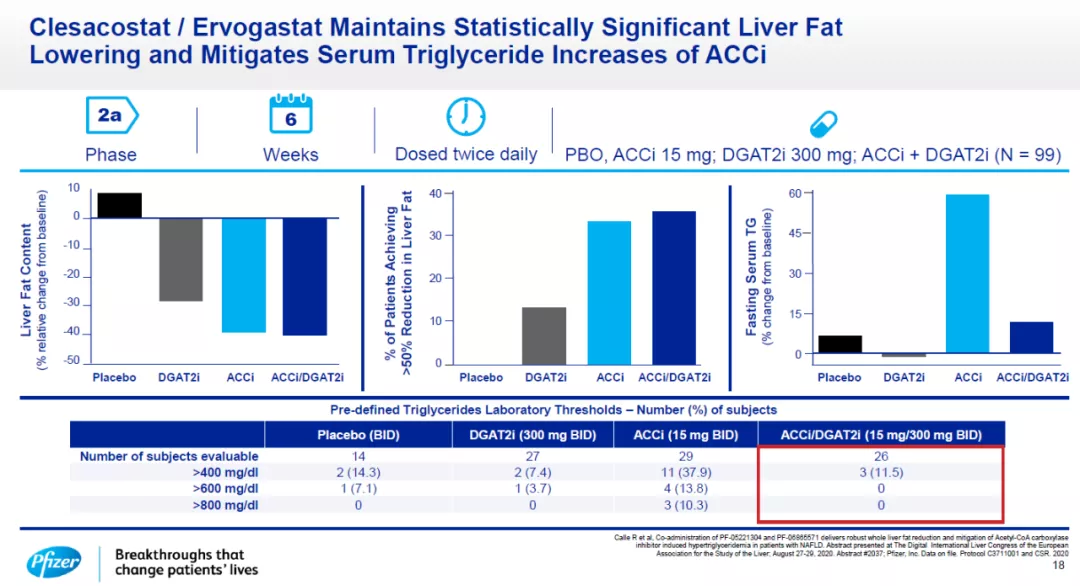
Clesacostat与ervigastat联用,显著降低肝脏脂肪水平
在治疗肥胖症和2型糖尿病方面,辉瑞开发的danuglipron是一款小分子GLP-1受体激动剂。GLP-1受体激动剂的开发已经有不断的历史,目前已经上市的利拉鲁肽、杜拉鲁肽、索马鲁肽等GLP-1类似物都在帮助糖尿病患者降低血糖方面取得良好的疗效。然而,这些多肽类药物通常需要患者通过注射接受治疗。诺和诺德开发的口服索马鲁肽在口服多肽类药物方面取得了重要突破,然而它的口服生物利用度并不高,需要患者服用更高的剂量才能达到注射剂型的同等效果。
在1期临床试验中,接受danuglipron治疗的2型糖尿病患者在服药四周后,空腹血糖水平,糖化血红蛋白(HbA1c)水平和体重都有显著的下降。辉瑞计划在今年晚些时候启动使用danuglipron治疗2型糖尿病患者和肥胖症患者的2期临床试验。该公司还将启动2b期临床试验,检验这款口服小分子GLP-1受体激动剂在治疗NASH患者时的功效。辉瑞认为,danuglipron的口服特征能够为糖尿病和肥胖症患者提供一款差异化的创新疗法。

口服GLP-1受体激动剂显著降低空腹血糖,HbA1c和体重
COVID-19研发动态
今天,辉瑞还介绍了该公司在COVID-19方面的研发进展。除了与BioNTech开发的疫苗以外,辉瑞还通过对公司化合物库的筛选,发现了一款针对病毒(SARS-CoV-2)的“first-in-class”病毒3L蛋白酶抑制剂。它在体外试验中,已经表现出对目前常见的病毒株的良好活性。而且,由于它与瑞德西韦具有截然不同的作用机制,这意味着它可以与瑞德西韦联用,产生叠加的抗病毒活性。目前这款抗病毒疗法已经开始1期临床试验,预计在今年第四季度获得治疗住院COVID-19患者的初步临床数据。
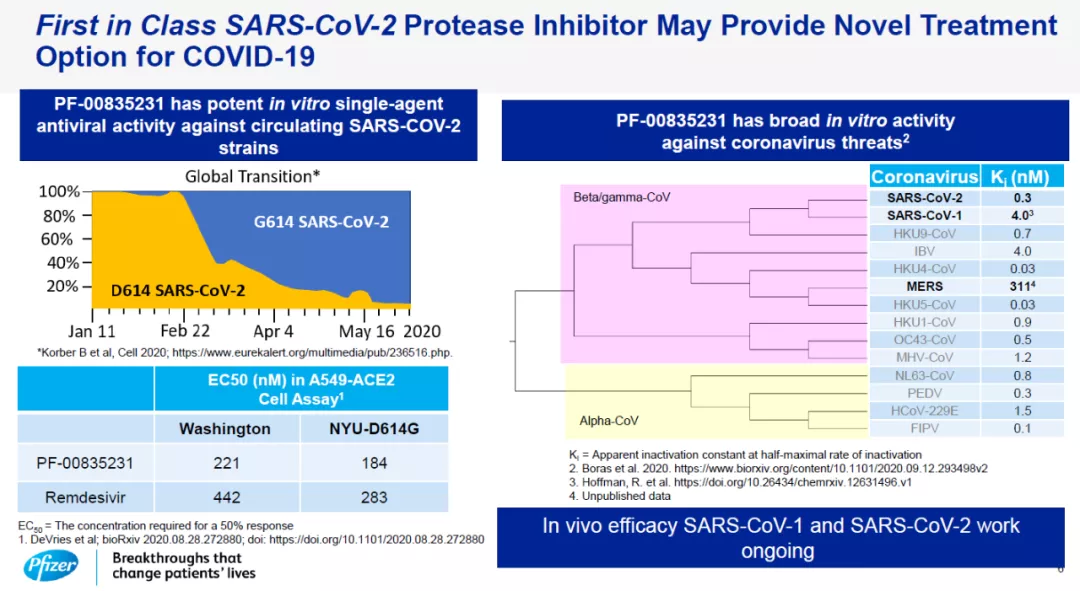
辉瑞开发的病毒蛋白酶抑制剂简介
截至9月14日,候选疫苗BNT162b2的3期临床试验已经注册29012名患者。截至8月27日,在已经接受两剂BNT162b2或安慰剂的1600多名志愿者中,研究人员观察到轻微或中度耐受性特征,与此前进行的1期临床试验类似。
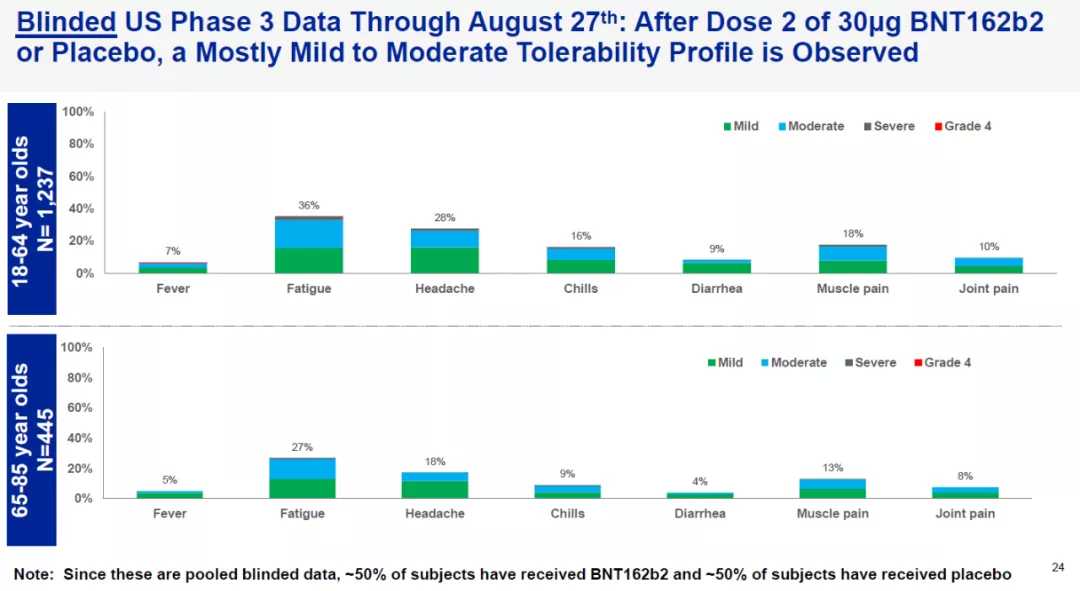
3期临床试验中部分参与者的耐受性特征,因为数据未揭盲,所以大约50%的数据来自接受安慰剂的参与者
在疫苗的生产和运输方面,辉瑞的研究发现这款候选疫苗在-70摄氏度的情况下可以保存6个月,在加有干冰的保温运输箱中可以保存15天,在2-8摄氏度的冷藏条件下可以保存5天。
除了提高BNT162b2的产能以外,辉瑞和BioNTech公司已经开始下一代候选疫苗的研发活动。它们的目标是开发一款能够以冻干剂型储存的疫苗,并且将接种次数由2次减少为1次。
(编辑:李国坚)



 扫码下载智通APP
扫码下载智通APP