国信证券:全球首个新冠疫苗分析显示保护力超90%,疫苗研发和商业化前景光明
本文源自 微信公众号“GuosenHealthcare”。
摘 要
事件:当地时间11月9日,辉瑞(PFE.US)公布全球首个新冠疫苗ph3试验中期分析初步结果。
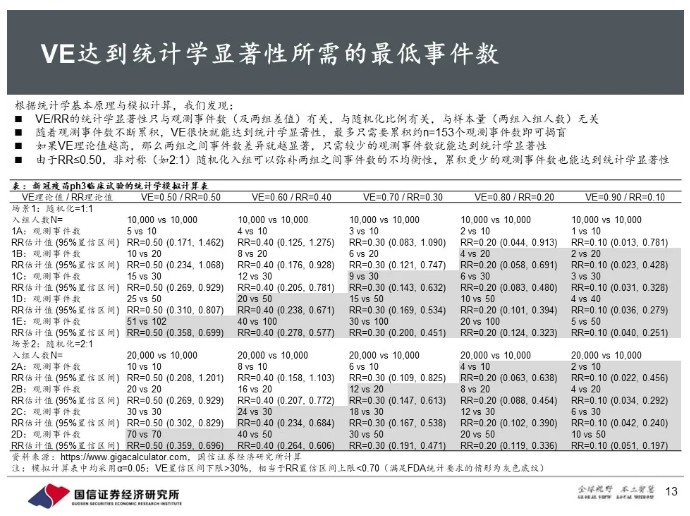
独立数据监察委员会(DMC)对94名确诊病例进行的中期分析显示,辉瑞、BioNTech合作研发的BNT162b2在完成接种程序后7天的有效性超过90%。
RNA疫苗显示出较高的短期保护力,完全符合我们此前预期。
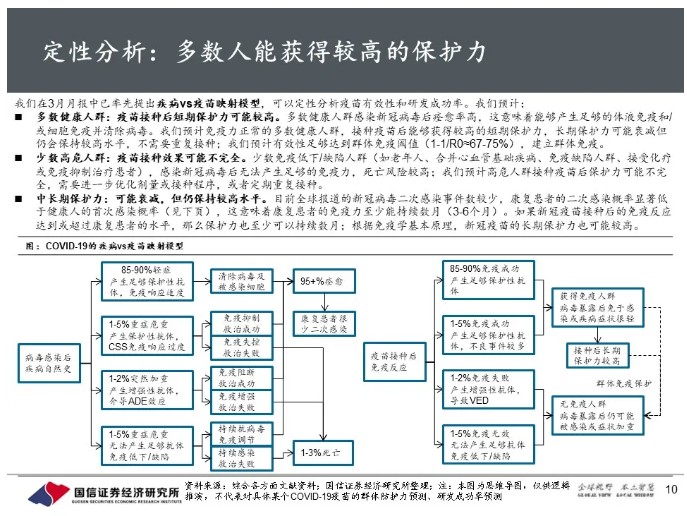
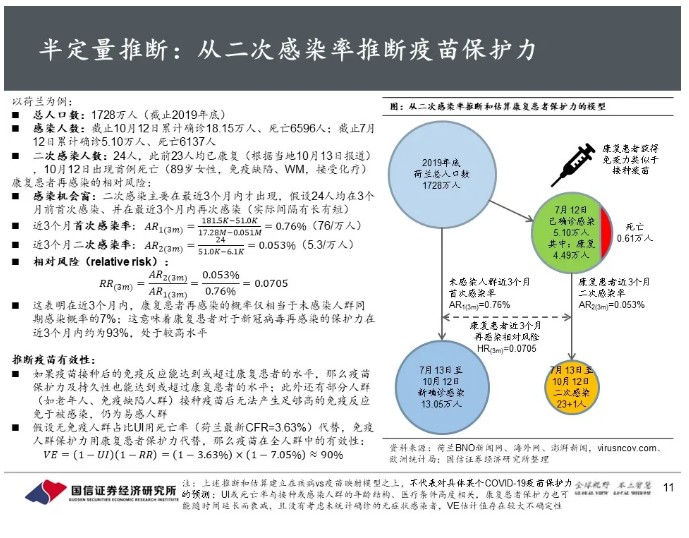
我们此前提出疾病vs疫苗映射模型,可以定性分析疫苗研发成功率:预计免疫力正常的多数健康人群,接种疫苗后能够获得较高的短期保护力;少数高危人群接种疫苗后保护力可能不完全。如果疫苗接种后的免疫反应能达到或超过康复患者的水平,那么疫苗保护力及持久性也能达到或超过康复患者的水平;根据荷兰报道的二次感染情况,半定量推断疫苗在全人群中的有效性约为90%。
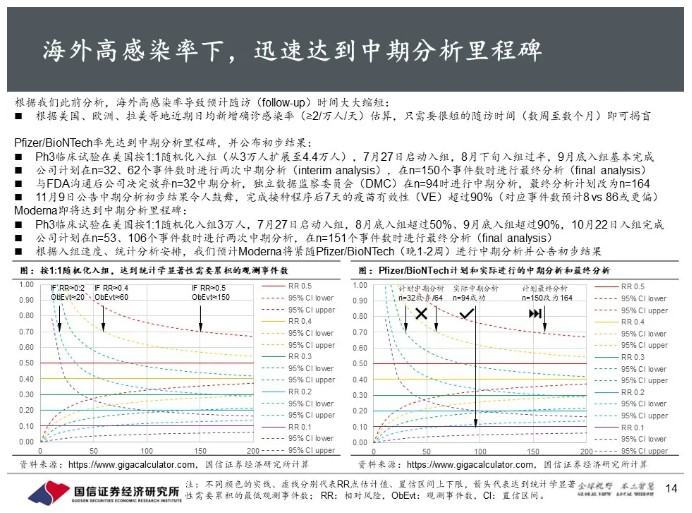
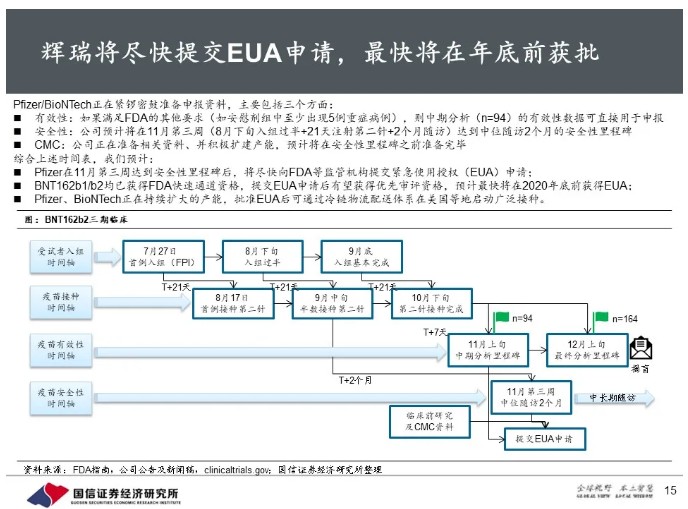
初步有效性远超监管要求,辉瑞将尽快提交紧急使用授权。
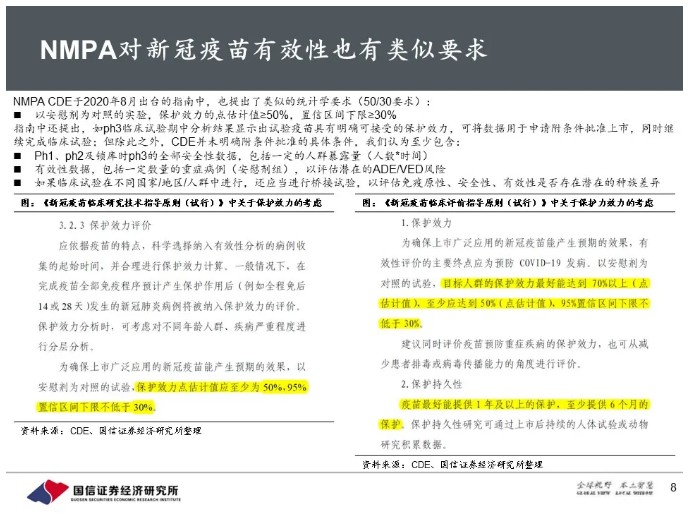
中期分析显示短期保护力超过90%,远远超过FDA指南中50/30的最低要求;如果能满足FDA的其他要求,可以直接用于申报。安全性方面,公司预计在11月第三周达到中位随访2个月的安全性里程碑,随后将尽快向FDA等监管机构提交紧急使用授权(EUA)申请。BNT162也获得FDA快速通道资格,预计最快将在2020年底前获得EUA。
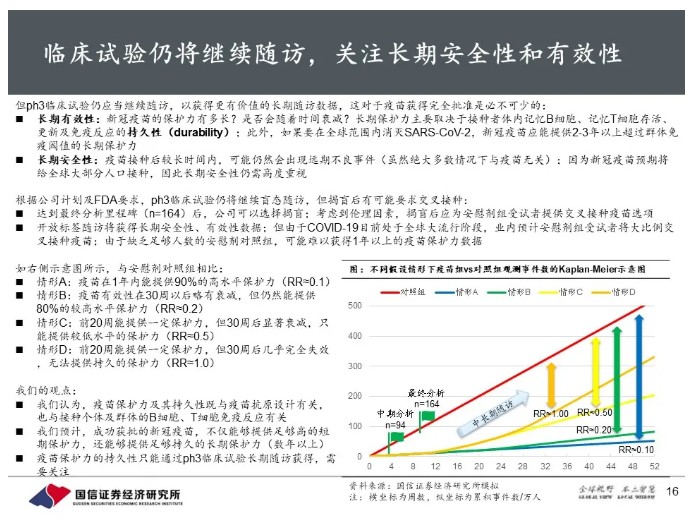
继续随访关注中长期安全性、有效性,预计将提供足够高且足够持久的长期保护力。
Ph3临床试验仍将继续盲态随访直到最终分析里程碑,公司选择揭盲后有可能交叉接种。开放标签随访将获得长期安全性、有效性数据。我们预计成功获批的疫苗,不仅能够提供足够高的短期保护力,还能够提供足够持久的长期保护力(数年以上)。
全新的RNA疫苗技术路线验证成药,后续治疗领域拓展值得期待。
公共卫生事件全球大爆发,给予全新的RNA疫苗技术路线弯道超车的机遇;BioNTech(BNTX.US)、Moderna(MRNA.US)等研发型公司在疫苗研发竞赛中处于领先地位,证明了自身的研发能力;而中期分析的初步结果,证明了RNA疫苗技术路线的成药性。除了新冠疫苗之外,RNA疫苗在流感、RSV等病毒感染疾病疫苗及肿瘤疫苗等其他治疗领域具有广阔前景,后续拓展值得期待。
风险提示:疫苗研发失败或长期有效性低于预期;监管审批要求发生重大不利变化;采购销售模式发生重大不利变化;全球政治经济社会风险。
投资建议:新冠疫苗研发和商业化前景光明、前途广阔。
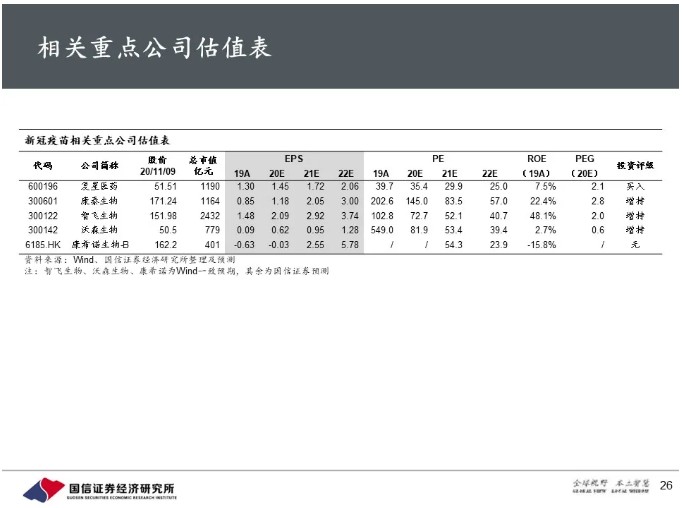
中期分析初步结果显示超过90%的高保护力,意味着BNT162b2具有全球同类首个(FIC)/同类最佳(BIC)潜力;复星医药(02196)授权引进BNT162系列候选疫苗的国内权益,维持“买入”评级。同时这也意味着其他新冠疫苗也都有可能达到相似的保护力水平,提高了整个领域的研发成功概率;康泰生物、沃森生物、智飞生物的其他新冠候选疫苗也有较好的研发和商业化前景,维持“增持”评级。
报告正文




















 扫码下载智通APP
扫码下载智通APP