一文读懂公共卫生事件疫苗行业全球竞备详略
本文来自“粤开证券微服务”
摘要
我国公共卫生事件疫苗研发包括5条技术路线,分别是灭活疫苗、腺病毒载体疫苗、减毒流感病毒载体疫苗、重组蛋白疫苗、核酸疫苗。在五条技术路线中,灭活疫苗是用被杀灭的病毒刺激健康人体内的免疫系统产生抗体,其他的路径均基于同一理论基础:刺突蛋白是公共卫生事件致病的关键抗原,可与人体细胞膜上的受体血管紧张素转化酶2(ACE2)结合,进而入侵并感染人体细胞。
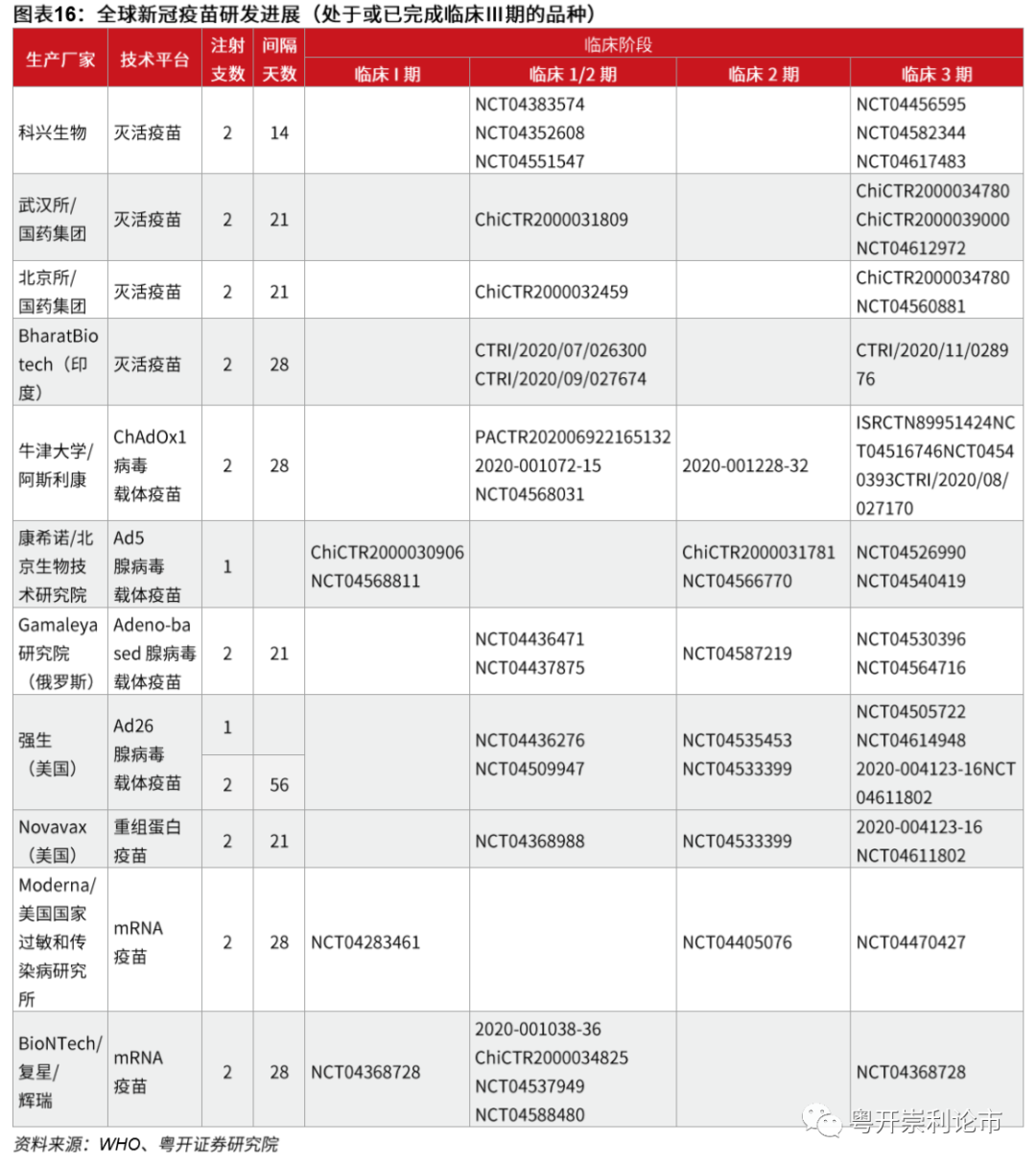
mRNA疫苗研发一骑当先,Moderna(MRNA.US)和BioNtech(BNTX.US)分庭抗礼。根据WHO的数据,截至2020年11月12日,全球已有48款公共卫生事件疫苗进入临床研发阶段,其中11款进入临床三期,另有164款处于临床前研发阶段。从目前的研发进程看,进入临床三期的11款疫苗包括4款灭活疫苗、4款重组载体疫苗、1款重组蛋白疫苗和2款mRNA疫苗,其中,mRNA疫苗研发一骑当先,Moderna和BioNTech/辉瑞(PFE.US)的mRNA疫苗均已提交上市申请。
我国共5款公共卫生事件疫苗处于临床三期,国药集团两款灭活疫苗或于12月中下旬率先上市。我国共5款公共卫生事件疫苗处于临床Ⅲ期,包括三款灭活疫苗、一款腺病毒载体疫苗和一款重组蛋白疫苗。其中,三款灭活疫苗分别由科兴生物(SVA.US)、国药集团北京所和国药集团武汉所研制;腺病毒载体疫苗由康希诺(06185)/军科院共同开发;重组蛋白疫苗由智飞生物/中科院微生物研究所共同开发。目前,国药集团的两款灭活疫苗处于领跑地位,已于11月末提交上市申请。根据12月2日孙春兰副总理的发言和12月4日王军志院士的演讲,我们认为,国药集团的灭活疫苗将于12月中下旬作为全国首个公共卫生事件疫苗获批上市,充分享有先发优势。
考虑到2021年国产疫苗产能和出口因素,未来处于公共卫生事件疫苗研发前列的企业将持续受益。根据目前5家临床三期企业公布的预产能,2021年国产疫苗可覆盖9-10亿人。此外,从海外订单数量看,2021年国内企业已与巴西等国签订超6亿剂的订单,这意味着2021年国内疫苗最多可覆盖6-7亿国内居民,国内公共卫生事件疫苗市场仍有巨大空间。因此,我们认为,在未来的数年内,处于公共卫生事件疫苗研发前列的企业将持续受益,包括国药集团、科兴生物、智飞生物、康希诺生物等。
公共卫生事件疫苗以成本作为定价依据,国产疫苗价格预计集中于60-200元/剂。公共卫生事件疫苗属于公共卫生产品,基本原则是定价不能以市场的供需矛盾作为定价依据,只能以成本作为定价依据。不同技术路线的疫苗定价不同,预计价格集中于60-200元/剂。对于灭活疫苗,可参考科兴生物在浙江嘉兴200元/剂的售价;对于腺病毒载体疫苗,可参考阿斯利康(AZN.US)18元/剂和强生60元/剂的价格;对于重组蛋白疫苗,可参考赛诺菲126元/剂的价格;对于mRNA疫苗,可参考Moderna164-243元/剂和BioNTech117元/剂的售价。
风险提示:疫苗研发结果不及预期,疫苗价格不及预期,疫苗严重不良反应风险。


一、公共卫生事件疫苗技术路线
2020年11月19日,国家药监局药审中心CDE发布《药品附条件批准上市技术指导原则(试行)》的通告(2020年第41号),通告指出在药物临床试验期间,符合下列两类情形的药品,可以申请附条件批准:
1.治疗严重危及生命且尚无有效治疗手段的疾病以及公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值的;
2.应对重大突发公共卫生事件急需的疫苗或者国家卫生健康委员会认定急需的其他疫苗,经评估获益大于风险的。
对于条件2,具体而言,应对重大突发公共卫生事件急需的疫苗或者国家卫生健康委员会认定急需的创新疫苗,基于Ⅲ期临床试验期中分析数据,经评估获益大于风险的也可附条件批准上市。例如,在疫苗的Ⅲ期临床试验中,可以按照方案设计,开展1-2次期中分析,由独立的数据监察委员会(IDMC)对期中数据进行审核,当其中分析结果显示试验疫苗在保护效力方面表现出优于安慰剂对照组并达到预先设立的标准,能够提示获益大于风险时,可申请附条件批准疫苗上市。
我们认为,随着新政策的出台,公共卫生事件疫苗可凭借Ⅲ期临床试验数据附条件批准上市,这将进一步加快公共卫生事件疫苗的研发进度,缩短上市进程,2021年我国将迎来疫苗上市高潮。11月25日,国药集团副总石晟怡表示国药集团已经向国家药监局提交了公共卫生事件疫苗的上市申请,是国内自主研发的首个提交上市申请的公共卫生事件疫苗产品。
(一)公共卫生事件病毒结构与特征
病毒是由一个核酸分子和蛋白质构成的非细胞形态,靠寄生生活的有机物种。根据病毒的定义,病毒的基本结构包括核心和衣壳,核心是由核酸(DNA或RNA)构成,位于病毒体的中心,核酸与病毒增殖、遗传变异关系密切。衣壳是包围在核酸外面的蛋白质外壳,可发挥保护病毒核酸的作用,具有抗原性。在衣壳外部,部分病毒的结构还包括囊膜(包膜)和刺突,薄膜和刺突可维护病毒体结构的完整性,并在病毒入侵感染时发挥作用。
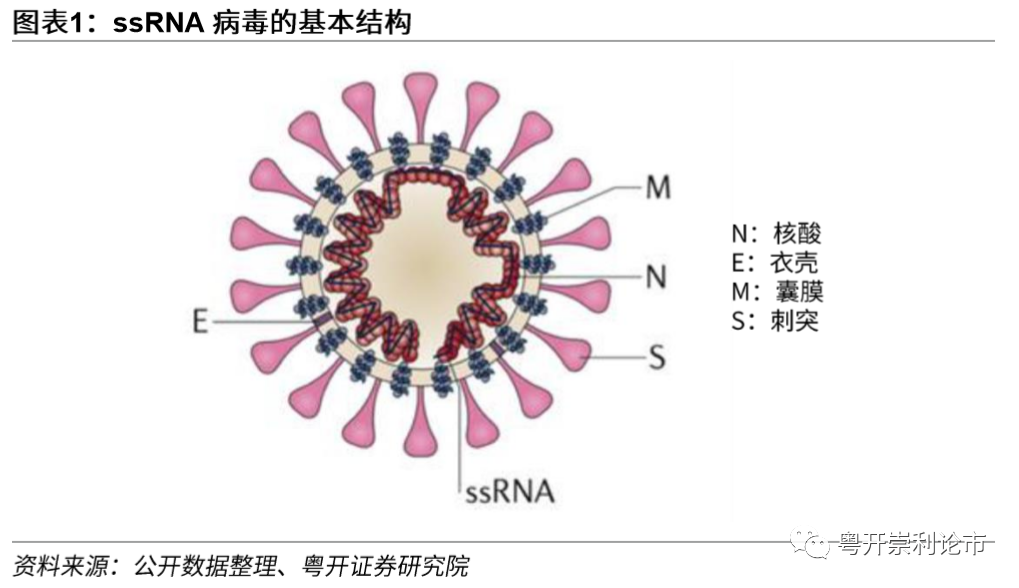
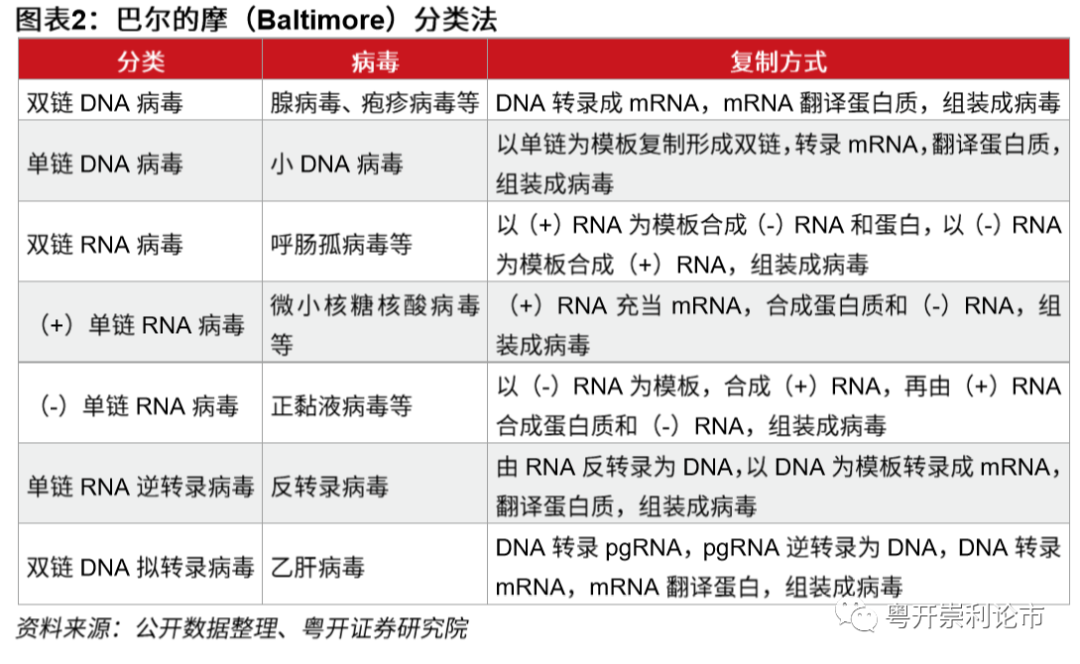
巴尔的摩病毒分类法是一种由戴维·巴尔的摩建立的以基因组和病毒转录mRNA方式为区分的病毒分类系统。病毒从基因组到蛋白质的转变中,必须要生成mRNA以完成蛋白质的合成和基因组的复制,不同的的病毒家族完成此过程的机制存在差异。根据巴尔的摩分类法,病毒可以分为DNA病毒和RNA病毒。其中,DNA病毒可以分为双链DNA病毒、单链DNA病毒、双链DNA逆转录病毒三种;RNA病毒可以分为双链RNA病毒、(+)单链RNA病毒、(-)单链RNA病毒和单链RNA逆转录病毒四种。
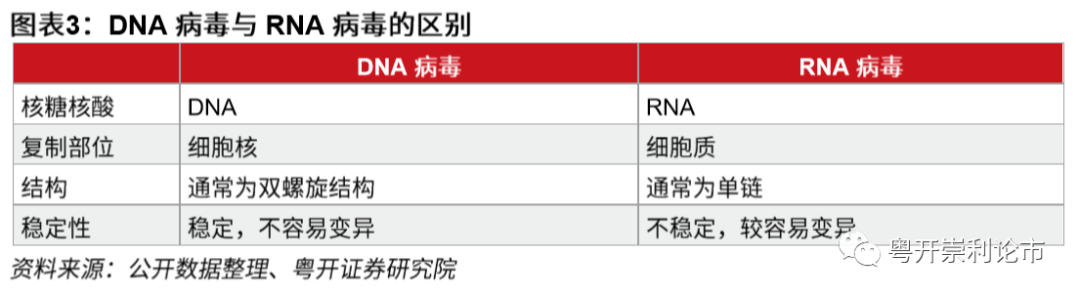
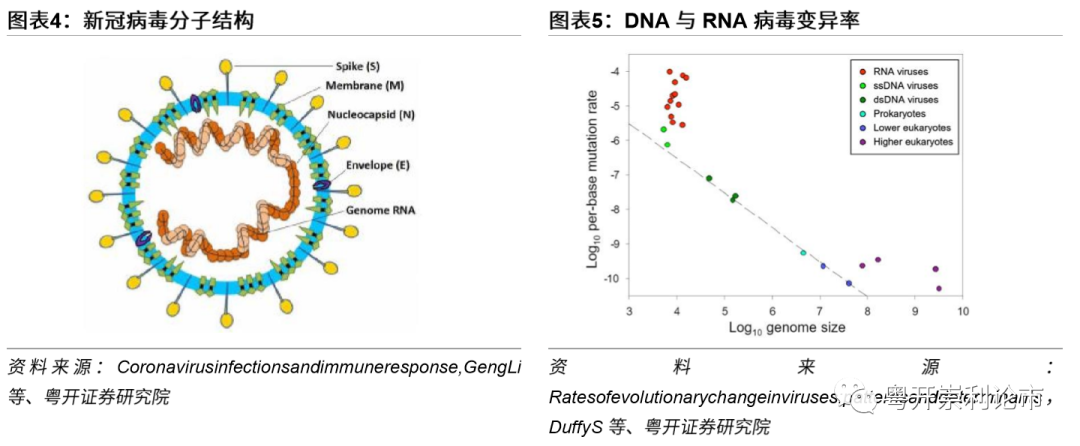
公共卫生事件病毒是一类(+)单链RNA病毒,疫苗研发难度较大。公共卫生事件病毒所包含的单链RNA相当于细胞中的mRNA,可以直接在细胞内翻译出所编码的蛋白质,如衣壳蛋白和病毒的RNA聚合酶。然后在病毒RNA聚合酶的作用下复制病毒RNA,最后病毒RNA和衣壳蛋白自我装配形成成熟的病毒颗粒。与DNA病毒疫苗相比,RNA病毒疫苗的研发更加困难,主要原因在于RNA病毒为单链结构,较双螺旋结构的DNA病毒稳定性差,变异速度更快,突变率更高。例如,SARS样公共卫生事件病毒是一款RNA病毒,经蝙蝠和果子狸传播时,不断发生变异,最终传播至人类,引发“非典”。
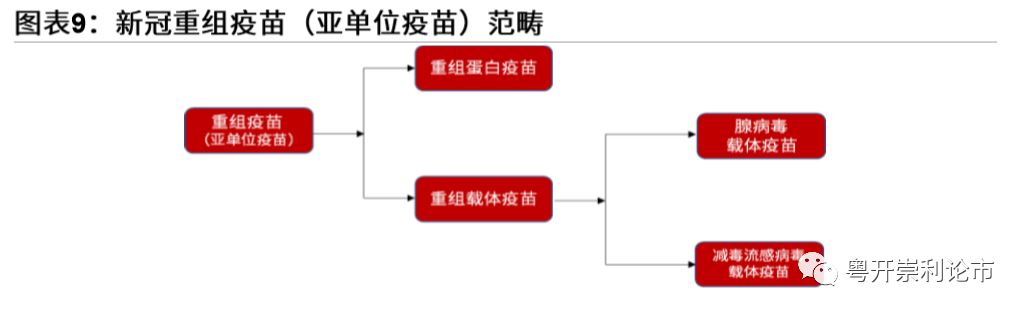
(二)公共卫生事件疫苗五大研发技术路线
2020年3月6日,国务院联防联控机制在北京国二招宾馆召开新闻发布会,介绍科技研发攻关最新进展情况。国家卫健委医药卫生科技发展研究中心主任郑忠伟指出,公共卫生事件疫苗研发包括5条技术路线,分别是灭活疫苗、腺病毒载体疫苗、减毒流感病毒载体疫苗、重组蛋白疫苗、核酸疫苗(包括RNA疫苗和DNA疫苗)。
在五条技术路线中,灭活疫苗是用被杀灭的公共卫生事件病毒刺激健康人体内的免疫系统产生抗体,其他的路径均基于同一理论基础:刺突蛋白(SpikeProtein,S蛋白)是公共卫生事件病毒致病的关键抗原,可与人体细胞膜上的受体血管紧张素转化酶2(ACE2)结合,进而入侵并感染人体细胞。针对S蛋白靶点可设计公共卫生事件疫苗,引发人体的免疫保护机制。重组蛋白疫苗在体外生产S蛋白,腺病毒、减活流感病毒和核酸疫苗可在体内产生S蛋白。

1、灭活疫苗
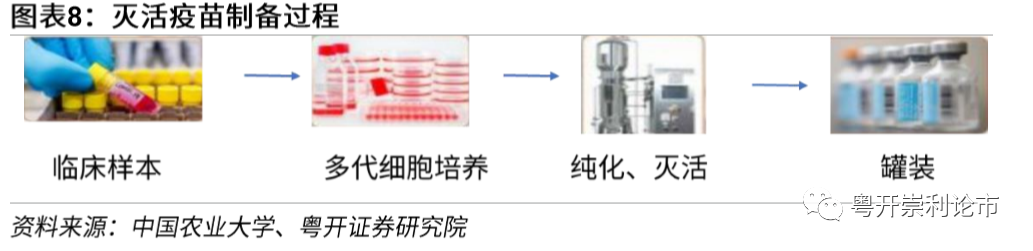
采用减活或灭活病毒作为抗原的疫苗均属于第一代的“全病毒疫苗”。全病毒疫苗尽管制备较为粗糙,但是疫苗最大程度的保留了病毒的广谱抗原性并有望全面激活机体的免疫反应,抗原性和免疫保护性较好。灭活疫苗是一种杀死病原微生物但仍保持其免疫原性的疫苗,制备方法为首先将病毒或细菌接种于动物、鸡胚、组织或细胞培养物中生长繁殖,然后通过加热、放射或化学剂(通常是福尔马林)等方式将其灭活。灭活疫苗的优点在于制备方法成熟,安全性较高,经过灭活的病毒不再具有感染和复制的能力。但是由于灭活疫苗的免疫原性和免疫保护性较减活疫苗有所降低,因此,灭活疫苗存在接种剂量大、免疫周期短等不足。
2、重组蛋白疫苗
重组疫苗通常只包含病毒抗原性蛋白中的一部分,因此也被称为“亚单位疫苗”。亚单位疫苗是随着基因工程技术发展而兴起的“第二代”疫苗技术平台。重组疫苗从形式上可分为“重组蛋白”和“重组载体”疫苗两种,前者以表达纯化后的病毒蛋白作为抗原,后者是将抗原表达在某种病毒或细菌载体上实现免疫原性。
在大分子抗原携带的多种特异性的抗原决定簇中,实际上只有少量抗原部位对保护性免疫应答起作用。重组蛋白疫苗即利用这一特点,筛选出病毒表面具有免疫原性的结构成分(抗原),制成不含有核酸、能诱发机体产生抗体的疫苗。
由于亚单位疫苗仅有数种主要表面蛋白质,避免产生许多无关抗原诱发的抗体,从而减少疫苗的副作用。此外,由于亚单位疫苗中不含有微生物的核酸,可降低全病原体疫苗较严重毒副作用的发生机率。但不足之处在于疫苗的免疫原性较低,需要配合佐剂,增强机体对抗原的免疫应答。
3、腺病毒载体疫苗
腺病毒载体疫苗属于重组载体疫苗。重组载体疫苗是指将抗原基因通过人体常见、不具有严重毒性的微生物(如腺病毒和减活流感病毒等)载入人体内,诱导机体的免疫系统做出免疫应答。腺病毒载体疫苗即以腺病毒为载体,将抗原基因重组入腺病毒基因组中,使用能表达保护性抗原基因的重组腺病毒制成的疫苗。公共卫生事件重组腺病毒载体疫苗使用的是人源5型腺病毒(Ad5),通过基因重组导入公共卫生事件病毒刺突蛋白基因片段,制成腺病毒载体疫苗,刺激人体产生抗体。Ad5腺病毒被广泛应用于重组基因治疗和疫苗载体,具有安全性高、容易复制、操作简单、相对稳定等特点。
腺病毒载体疫苗安全性高,但有效性不足。腺病毒载体疫苗的优点一方面在于病毒载体本身可以提供一定的免疫刺激,部分取代了佐剂的作用,因而相对安全;另一方面在于不同的抗原可以使用同一种载体传递系统,一次免疫便可以实现多种疾病机体抵抗的效果。但腺病毒载体疫苗研发需要考虑如何克服“预存免疫”。预存免疫是指若患者过往曾经感染过Ad5并存在预留抗体,当腺病毒再次进入体内时,体内的腺病毒抗体会优先攻击载体,降低疫苗效果。在临床中,科学家曾将埃博拉病毒患者分为非预存免疫组和预存免疫组,实验发现,非预存免疫组注射埃博拉腺病毒疫苗后,体内的抗体水平远高于预存免疫组抗体水平,证实了预存免疫理论的科学性和真实性。
4、减毒流感病毒载体疫苗
减毒流感病毒载体疫苗同样属于载体疫苗,与腺病毒载体疫苗使用腺病毒作为载体不同,减毒流感病毒载体疫苗使用减毒流感病毒作为载体,将公共卫生事件病毒的致病刺突蛋白基因片段通过基因工程插入减毒的普通季节性流感病毒载体上,使减毒性流感病毒携带公共卫生事件病毒基因后形成融合病毒。融合病毒进入体内后,刺激人体免疫系统产生流感抗体和公共卫生事件抗体,是目前唯一可用于抗流感和抗公共卫生事件的疫苗,临床意义巨大。
减毒流感病毒载体疫苗的优点在于双重预防功效。同时,由于减毒流感病毒容易感染鼻腔,因此减毒流感病毒载体疫苗通过滴鼻的方式便可完成接种,接种方式简便。缺点在于研发难度较高、研发过程漫长,此外,采用流感病毒作为载体的疫苗也会受到预存免疫的限制。9月20日,由厦门大学、香港大学和万泰生物共同研发的鼻喷流感病毒载体公共卫生事件疫苗通过国家药品监督管理局的应急审批,获批开展临床试验,标志着我国五条技术路线应急研发的公共卫生事件疫苗均已推进到临床试验阶段。
5、核酸疫苗
核酸疫苗被称为继全病毒疫苗、重组亚单位疫苗之后的第三代疫苗,作为一种基于全新技术的疫苗,目前尚未有人用核酸疫苗批准上市。核酸疫苗包括DNA疫苗和RNA疫苗,是指将含有编码的蛋白基因序列的质粒载体,经过一定的手段方法,如脂质体纳米粒(LNP)递送入宿主体内,通过宿主细胞表达抗原蛋白,从而诱发机体对该蛋白的免疫反应,进而达到预防疾病的目的。由于公共卫生事件病毒本身是一种(+)单链RNA病毒,使用核酸疫苗技术路线制备的公共卫生事件疫苗可以在人体内翻译抗原蛋白,快速诱导人体产生免疫。
核酸疫苗使用的是质粒载体,并非病毒的染色体。质粒是一种寄宿于细胞内,独立于染色体外的自我复制并稳定遗传的环形双链DNA分子。质粒与染色体均与生物遗传相关,携带能转录并表达为蛋白质的基因,不同点在于染色体是生物信息的携带者,拥有大量遗传信息,而质粒为仅携带一些表达有特殊功能的蛋白质的基因。因此,使用以质粒载体为基础的核酸疫苗的设计和制备较使用染色体制备的疫苗更加简便快捷。

对于第一代和第二代非核酸疫苗,生产需要在车间或流水线完成微生物培养、蛋白质/多肽的生产和提纯等,流程繁琐。而核酸疫苗的生产或许将彻底颠覆传统流程,仅须复制病毒核酸即可完成疫苗的生产,极大地简化了生产流程。但是,核酸疫苗的大规模运用仍面临许多亟待解决技术层面的问题。一是核酸疫苗的抗原性较低,这与核酸疫苗在宿主细胞中的表达水平密切相关,因此在核酸疫苗的设计中,必要时须使用免疫刺激剂或提升剂量以增强疫苗的效力;二是大剂量或诱发炎症反应,由于核酸疫苗是一种“活疫苗”,随着疫苗剂量的提升,高龄患者或免疫力弱的患者可能爆发炎症反应和自身免疫病;第三,核酸自身稳定性差,易被体内核酸酶降解,因此需要合适的递送载体将其送至体内。
二、全球公共卫生事件疫苗研发概述
根据WHO统计数据,截至2020年11月12日,全球已有48款公共卫生事件疫苗进入临床研发阶段,其中11款进入临床三期,另有164款处于临床前研发阶段。从目前的研发进程看,进入或完成Ⅲ期临床的11款疫苗包括4款灭活疫苗、4款重组载体疫苗、1款重组蛋白疫苗和2款mRNA疫苗。其中,我国科兴生物、国药集团参与灭活疫苗的研发,康希诺参与腺病毒载体的研发,康泰生物负责牛津大学/阿斯利康(AZN.US)腺病毒载体中国区的商业化活动,复星医药负责BioNTech/辉瑞mRNA疫苗中国区的商业化活动。根据12月2日国务院副总理孙春兰的讲话,除了以上4款国产疫苗进入临床三期,智飞生物的重组蛋白疫苗也进入了临床三期。
(一)mRNA疫苗
mRNA疫苗属于核酸疫苗,是指将在体外合成病毒相关序列mRNA传递到人体细胞内形成免疫。与灭活疫苗和重组疫苗相比,mRNA疫苗的生产无需依赖细胞扩增的过程,生产更容易放大。目前全球共有两款mRNA疫苗进入临床Ⅲ期,分别是美国Moderna公司研发的mRNA疫苗和美国辉瑞(Pfizer)、德国BioNTech共同研发的mRNA疫苗。上述公司均于11月对外公布了疫苗Ⅲ期临床最终数据,并提交上市申请。
1、Moderna
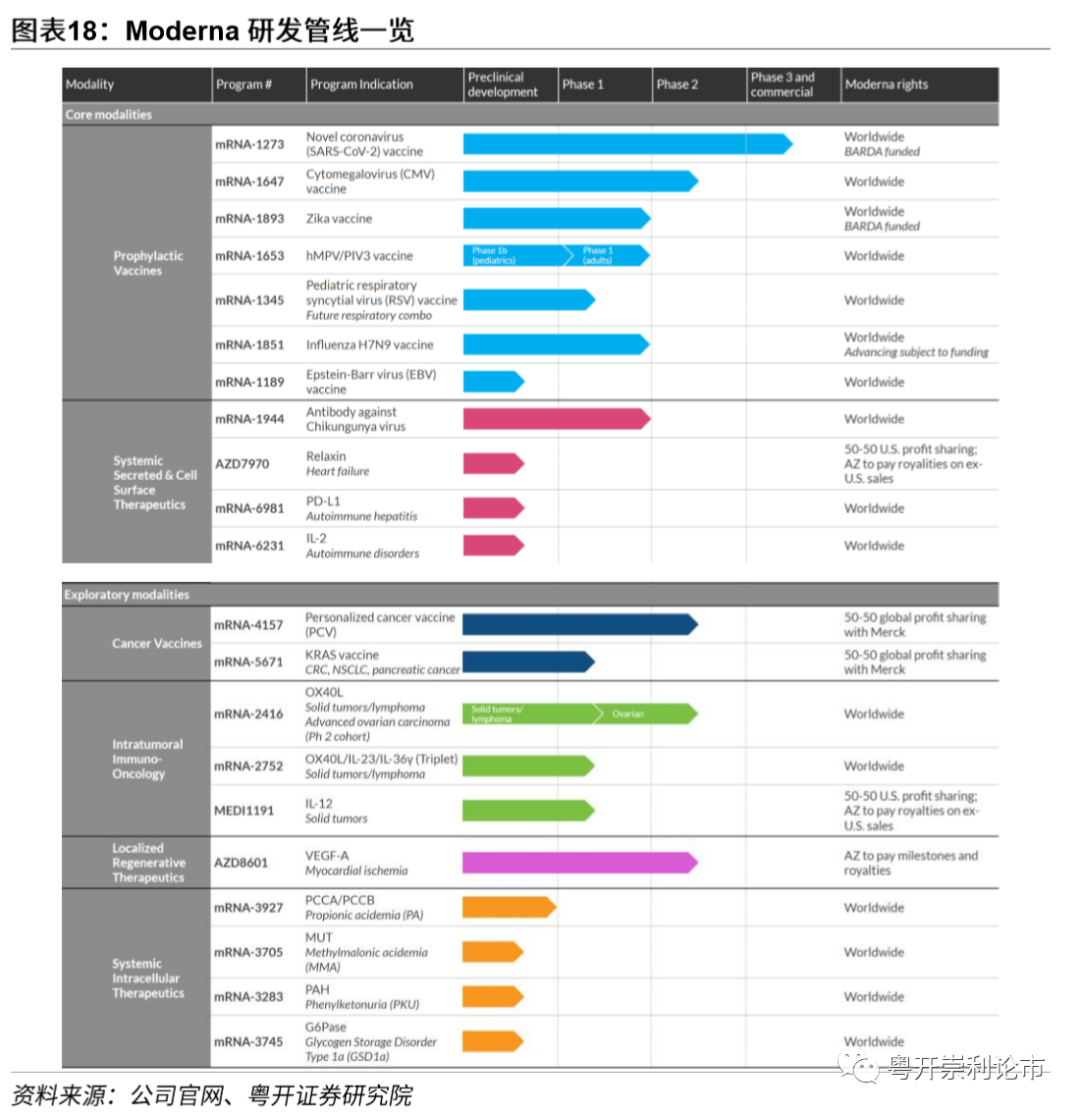
Moderna公司成立于2010年,总部位于美国马萨诸塞州剑桥市。公司专注于信使RNA(mRNA)的研究并致力于成为全球mRNA药物发现和药物开发的先行者和引领者。目前公司的研发管线共有21款疫苗和药物,其中公共卫生事件(SARS-COV-2)疫苗处于临床Ⅲ期,包括巨细胞病毒(Cytomegalovirus)疫苗、个性化癌症疫苗等在内的4款药物处于临床Ⅱ期,8款药物处于临床Ⅰ期。值得一提的是,在公司研发管线中,21款药物中有18款药物和疫苗均为mRNA药物。
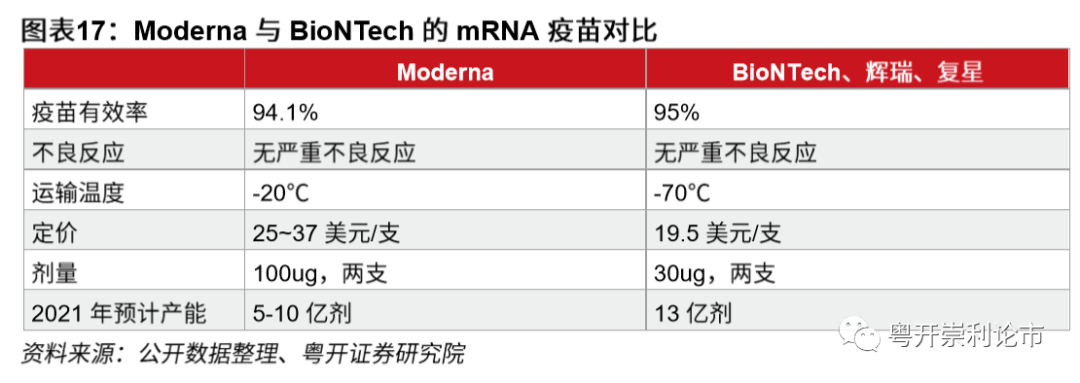
Moderna疫苗有效率达94.1%。11月30日,Moderna发布疫苗试验最终数据,在30000名受试人群中,196名患者出现公共卫生事件反应,其中包括30名重症公共卫生事件患者。在196名公共卫生事件患者中,接种安慰剂的有185例,接种疫苗的仅11例,这意味着疫苗对于预防公共卫生事件感染的有效率高达94.1%,对重症病例的有效率达100%。尽管最终结果略低于Ⅲ期期中94.5%的结果,但远高于FDA对上市疫苗达到50%有效率的评估要求。

Moderna的mRNA疫苗易于存储,普适性较高。由于mRNA疫苗较不稳定,因此对疫苗的存储条件要求十分严苛。辉瑞的mRNA疫苗需要在超低温环境下存储,在-70摄氏度的冰冻箱中可保存6个月,在加有干冰的特制保温运输箱中可保存15天,而在普通医院冰箱2-8℃的环境中仅可保存5天,这对于医院和药房提出了设备更新换代的要求,因为医院通常未配备超低温冷冻箱,而售价通常高达3-10万元的超低温冷冻箱对于发展中国家和贫穷国家的医疗机构并不友好。ModernamRNA疫苗对于存储环境的要求则宽松许多,在零下20℃的环境中可保存6个月,在2-8℃的普通冰箱中可保存一个月,甚至在室温环境中也可以保存12个小时,极大地增强了疫苗的普适性。实际上,Moderna疫苗对温度的宽松得益于公司特有的脂质纳米颗粒技术,该技术可将RNA药物、疫苗等递送入细胞,从而增强疫苗的稳定性。
Moderna疫苗价格约为328~486元。Moderna公司的mRNA疫苗单剂价格为25~37美元,由于需要注射两支,整体价格达50~74美元。以12月1日人民币兑美元汇率计算(1美元=6.57元人民币),疫苗价格约为328~486元之间。从产能的角度,Moderna目前已经完成数百万剂疫苗的生产,到年底预计生产2000万支。此外,为了弥补产能的不足,在美国政府的帮助下,公司已经与诸多制药公司建立了合作伙伴关系,以协助疫苗生产,提高产能,包括美国康泰伦特药业、瑞士龙沙集团、西班牙Rovi公司等。公司预计2021年可为全球生产5-10亿剂mRNA疫苗。
2、BioNTech、辉瑞和复星
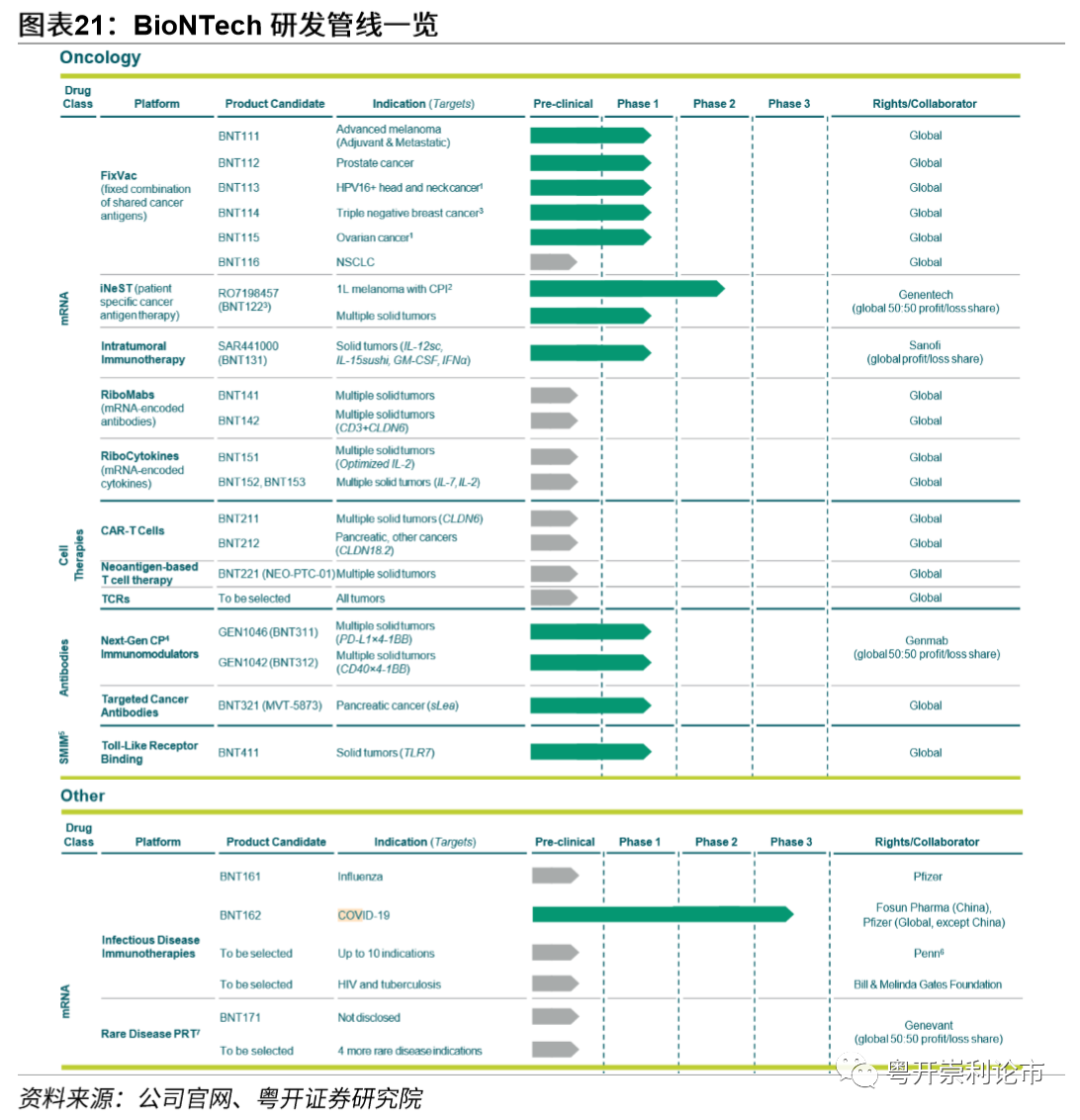
BioNTech公司创立于2008年,总部位于德国,和Moderna、CureVac并称为全球三大mRNA疗法引领者。公司的尖端产品包括个性化基于mRNA的候选产品、创新嵌合抗原受体T细胞、新型检查点免疫调节剂、靶向的癌症抗体和小分子药物等。此外,公司还为传染病、过敏和自身免疫性疾病等其他治疗领域提供诊断产品和药物开发服务。在公司研发管线中,目前共有13款药物处于临床阶段,14款药物处于临床前阶段。对于处于临床阶段的13款药物,公共卫生事件疫苗BNT162处于临床Ⅲ期,靶向黑色素瘤的RO7198457处于临床Ⅱ期,其余11款药物处于临床Ⅰ期。
Ⅲ期临床最终结果显示疫苗有效率达95%。11月18日,辉瑞和BioNTech公布了三期临床试验最终功效分析,在43000名受试者中,一共产生了170例确诊病例,其中安慰剂组共162例,mRNA疫苗组仅8例,BioNTech的mRNA疫苗有效率高达95%。此外,在Ⅲ期临床试验中,疫苗接种人群年龄范围为12-85岁,涵盖心肝肺慢性病患者、免疫缺陷患者、艾滋病患者、肝炎患者,针对特定人群表现出良好的耐受性,并未出现任何严重的安全隐患。
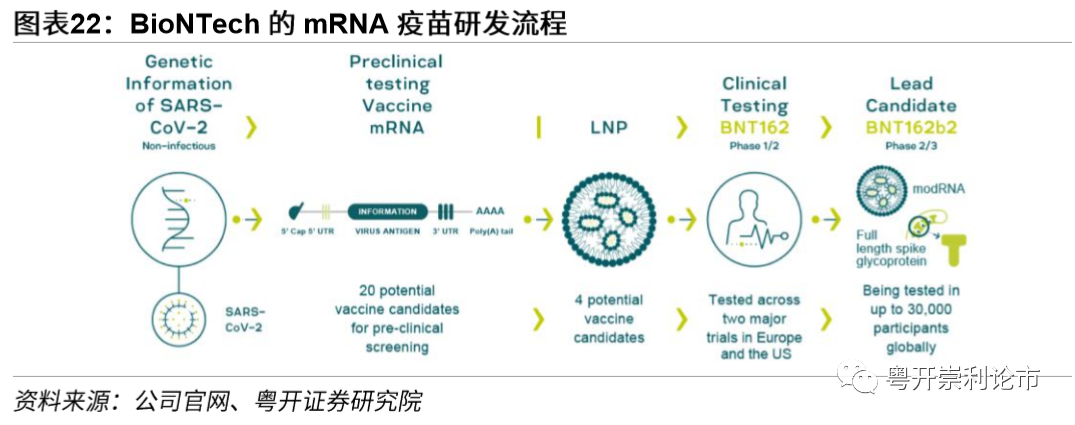
BioNTech的公共卫生事件疫苗进展顺利,有望在底获批上市。11月末,BioNTech和辉瑞表示已向欧洲药品管理局(EMA)、美国食品药品管理局(FDA)和英国药品和保健品管理局(MHRA)提交了有条件上市许可或紧急使用申请,有望在年底获批。11月30日,欧洲药品管理局已确认BioNTech和辉瑞成功申请公共卫生事件候选疫苗BNT162b2有条件上市许可。12月2日,英国政府接受了独立的英国药品和医疗器械监管署(MHRA)的建议,批准辉瑞/BioNTech公共卫生事件疫苗的紧急使用,自12月7日向全英国人民供应公共卫生事件疫苗。
BioNTech疫苗价格比Moderna疫苗便宜三成。BioNTech疫苗价格今年7月,辉瑞与美国政府达成协议,将以两剂39美元,或每剂19.5美元的价格供应1亿剂潜在疫苗,以及在一定条件下再销售5亿剂疫苗的选择权,条件将另行磋商。以两剂39美元的价格换算,BioNTech的mRNA疫苗价格约253元,较Moderna疫苗最低25美元的定价便宜近三成。
BioNTech疫苗的使用剂量较Moderna疫苗显著降低。BioNTech的mRNA疫苗与Moderna的mRNA疫苗的注射频率一致,均为两支,间隔28天。但从剂量的角度,BioNTech使用的是30ug的疫苗,而Moderna的mRNA疫苗剂量高达100ug,前者的剂量较后者显著降低。mRNA作为一种全新的技术,高剂量是否会诱发新风险,尤其是中长期的风险,尚需要待疫苗上市后在Ⅳ期试验中进一步观察。
BioNTech和辉瑞预计,截至2020年底,双方可生产5000万剂mRNA疫苗,实现2500万人的接种覆盖。截至2021年,双方将通过将进一步扩大产能,完成供应13亿剂疫苗的目标。

BioNTech的mRNA疫苗在中国的开发和商业化权力独家归属复星医药。复星医药在2020年3月便获得BioNTech授权,在中国大陆及港澳台地区独家开发、商业化基于BioNTech专有的mRNA技术平台研发的、针对公共卫生事件的疫苗产品。7月15日,复星医药的BNT162b1mRNA获批临床。11月24日启动Ⅱ期临床试验,试验由江苏省疾控中心负责,泰州市人民医院、涟水县人民医院、涟水县疾控中心等单位共同参与。
3、我国在研的mRNA疫苗
目前我国共有四款mRNA疫苗在研,其中,由沃森生物、艾博生物和军事医学研究院共同研制的ARCoVmRNA疫苗目前处于临床Ⅰ期,由复旦大学林金钟团队、上海交通大学徐颖洁团队和蓝鹊生物共同研发的两款、由斯微生物、同济大学、中国疾病预防控制中心共同研发的一款mRNA疫苗正处于临床前阶段。
6月26日,云南沃森生物、苏州艾博生物和军事科学院军事医学研究院共同研制的公共卫生事件病毒mRNA疫苗(ARCoV)通过国家药品监督管理局临床试验批准,这是国内首个获批开展临床试验的mRNA疫苗,目前该产品处于Ⅰ期临床试验阶段。

ARCoV动物实验疗效良好,剂量低,稳定性高。ARCoV是一个脂质纳米颗粒包裹的mRNA(mRNA-LNP),编码SARS-CoV-2的受体结合域。疫苗在小鼠体内效果良好,两次免疫2ug或10ug接种可以帮助小鼠抵御公共卫生事件感染。同时,ARCoV为热稳定性mRNA疫苗,可在室温下保存一周以上,稳定性显著高于Moderna与BioNTech的mRNA疫苗。
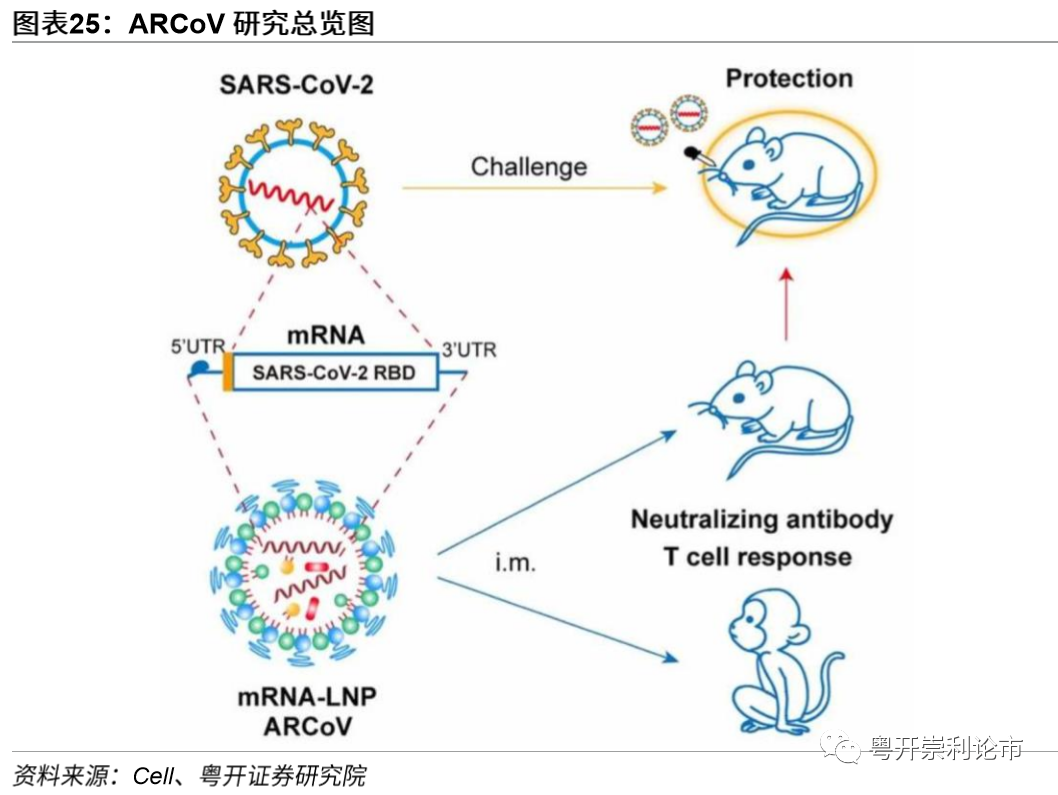
由复旦大学林金钟团队、上海交通大学徐颖洁团队和上海蓝鹊生物(RNACureBiopharma)研发的两款mRNA疫苗目前正处于临床前阶段。其中一款mRNA疫苗的设计思路与Moderna、BioNTech的一致,利用mRNA表达公共卫生事件表面的S蛋白,诱导体内产生病毒抗体。
另一款mRNA疫苗运用了病毒样颗粒的概念,病毒样颗粒是指外观与真实病毒相同,但不携带基因遗传物质,因而没有感染性的空病毒。团队希望通过mRNA技术,在人体内表达与公共卫生事件病毒形状相同的空病毒,引导机体免疫系统产生保护性抗体。由于空病毒不含有病毒mRNA,因此病毒样颗粒被认为是最安全的疫苗。但是这一技术挑战极大,尤其是对于结构复杂的公共卫生事件病毒,尚未有团队成功合成公共卫生事件病毒颗粒。凭借蓝鹊生物的mRNA药物研发平台,团队目前已获得了能高效表达公共卫生事件病毒四个结构基因的修饰mRNA分子,首次成功实现了公共卫生事件病毒颗粒的表达。
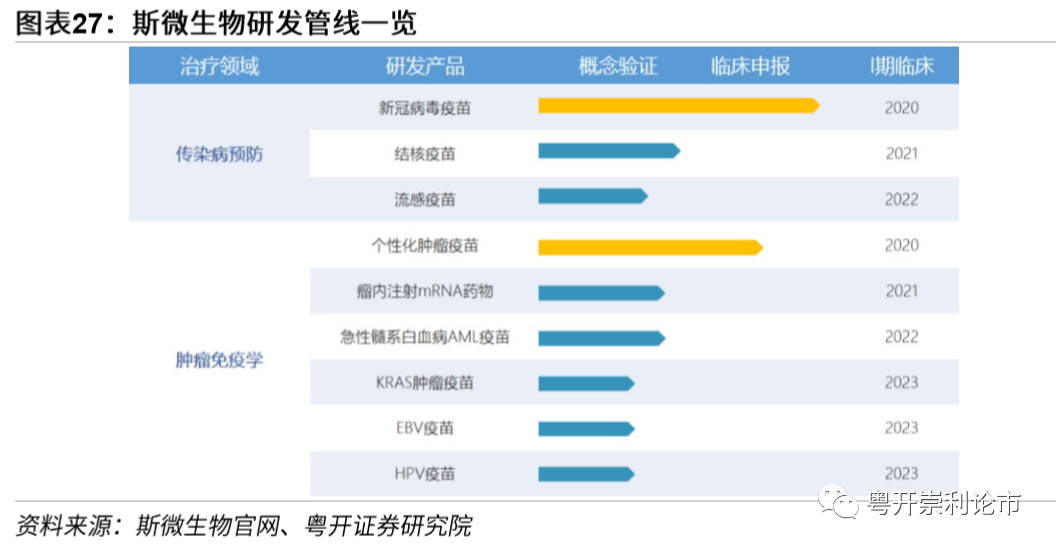
由斯微生物、同济大学、中国疾病预防控制中心(CDC)共同研发的mRNA疫苗,目前正处于临床前阶段。斯微生物公共卫生事件疫苗的生产、使用和商业化等权利归属西藏药业,6月15日,西藏药业以3.5亿元,获得了斯微生物公共卫生事件疫苗独家开发、注册、生产、使用和商业化权利。9月8号,西藏药业再次斥资3.4亿元向上海临港华平经济发展有限公司购买位于中国上海市临港奉贤园区临港智造园六期项目的房地产,用于疫苗上市后的生产。
(二)灭活疫苗
灭活疫苗是最传统的疫苗经典技术路线,通过在体外培养公共卫生事件病毒,然后将其灭活,消除其毒性,再将灭活病毒回输入体内,灭活病毒进入体内后,由于具有抗原性,可刺激免疫系统产生抗体。灭活疫苗必须在P3实验室中生产,如果需要大规模生产,其实验室的生物安全保障和检测技术必须要达到世界一流的水平。我国在P3实验室的布局较早,技术较为成熟,灭活疫苗整体走在全球前列。
目前全球共有四款灭活疫苗进入临床Ⅲ期,其中三款来自中国,一款来自印度,中国的灭活疫苗分别由科兴生物、武汉所/国药集团、北京所/国药集团研发,印度的灭活疫苗由BharatBiotech公司研发。
1、科兴生物
科兴控股生物技术有限公司是一家总部位于北京的高新技术企业,致力于人用疫苗及相关产品的研究开发、生产和销售,为疾病预防控制提供服务。目前公司在纳斯达克全球精选市场(NasdaqGS:SVA)上市,拥有肠道病毒71型灭活疫苗(益尔来福®),中国第一支通过WHO预认证的甲肝灭活疫苗(孩尔来福®),三价流感病毒裂解疫苗(安尔来福®),四价流感病毒裂解疫苗,水痘减毒活疫苗,甲型乙型肝炎联合疫苗(倍尔来福®)以及腮腺炎减毒活疫苗等十余款上市疫苗。
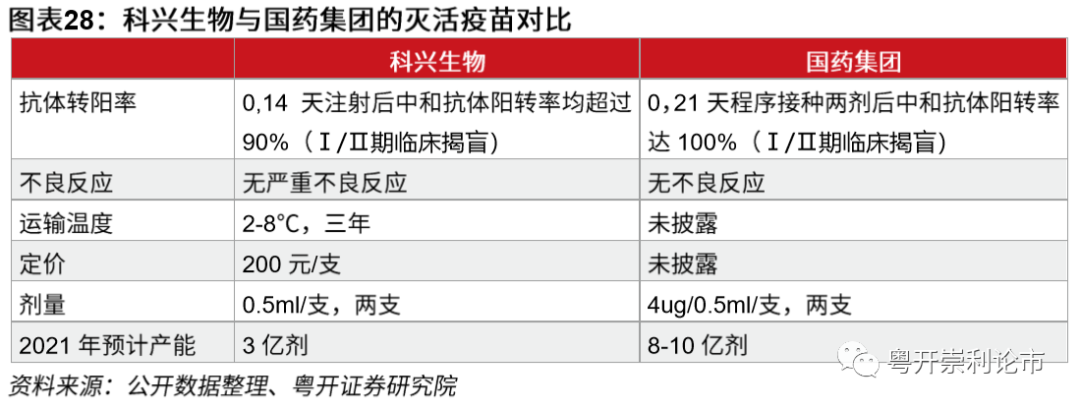
克尔来福安全性较好,有效率数据预计12月中出炉。科兴生物的灭活疫苗通用名为公共卫生事件病毒灭活疫苗(Vero细胞),商品名克尔来福,4月14日,科兴生物旗下科兴中维研制的克尔来福获批临床。在临床前实验中,克尔来福在小鼠、大鼠和非人灵长类动物体内可较好地诱导动物体产生SARS-CoV-2特异性中和抗体。抗体可有效中和10个代表性SARS-CoV-2毒株,对于全球流行的SARS-CoV-2具有广泛的中和能力。
在Ⅰ、Ⅱ期临床中,公司共纳入5000人参与试验,在6月的盲态审查暨揭盲会中,Ⅰ/Ⅱ期安全性数据显示,疫苗不良反应以1级为主,主要表现为接种部位轻度疼痛,个别受试者出现乏力及低热等,无严重不良反应报告。Ⅱ期临床研究结果显示,全程免疫14天后中和抗体阳转率超过90%,疫苗免疫原性较高。三期临床试验目前正在巴西、印度尼西亚等国开展,11月28日,在2020首届中国卫生健康科技创新发展大会上,科兴控股生物技术有限公司董事长尹卫东表示,预计12月中完成中期分析。
克尔来福的单价预计为200元/支,两剂共400元。克尔来福于7月22日获批我国公共卫生事件疫苗紧急使用。10月中旬,浙江启动公共卫生事件疫苗紧急接种,根据浙江省嘉兴市疾控中心官方微信,嘉兴市使用的公共卫生事件疫苗由省级部门统一向北京科兴生物征订,疫苗价格为200元/支,接种2剂共400元。对于注射间隔,WHO文件指出是14天,但出于安全考虑,嘉兴疾控表示两支疫苗使用须间隔14-28天,推荐间隔28天。
科兴生物公共卫生事件疫苗全球订单已超过1亿剂。从产能的角度,科兴生物与3月底启动了公共卫生事件灭活疫苗产业化建设项目,已在大兴生物医药产业基地完成了生产车间的建设,该车间可年产3亿剂公共卫生事件疫苗。从需求的角度,巴西、印尼、智利等国家均与科兴生物签订供应合同,合同量已超1亿剂。11月19日,巴西圣保罗州政府接受了科兴生物首批共计12万剂灭活疫苗,这是该州拟进口600万剂科兴疫苗的一部分,后续的疫苗原料将分批运抵巴西,并由圣保罗州布坦坦研究院生产另外4000万剂疫苗。8月,科兴与印尼制药公司BioFarma签署了4000万剂的公共卫生事件疫苗半成品。10月,智利卫生部与科兴生物达成协议,订购了2000万剂公共卫生事件疫苗。
2、国药集团
国药集团是由国务院国资委直接管理的唯一一家以医药健康产业为主业的中央医药企业,是国家创新型企业。旗下有1500余家子公司和国药控股(01099)、国药股份、国药一致、天坛生物、现代制药、中国中药(00570)6家上市公司,员工总人数15万人。本次负责公共卫生事件疫苗研发的武汉生物制品研究所和北京生物制品研究所属于中国生物技术股份有限公司的下设研究所,中国生物技术股份有限公司为国药集团下属的成员企业。
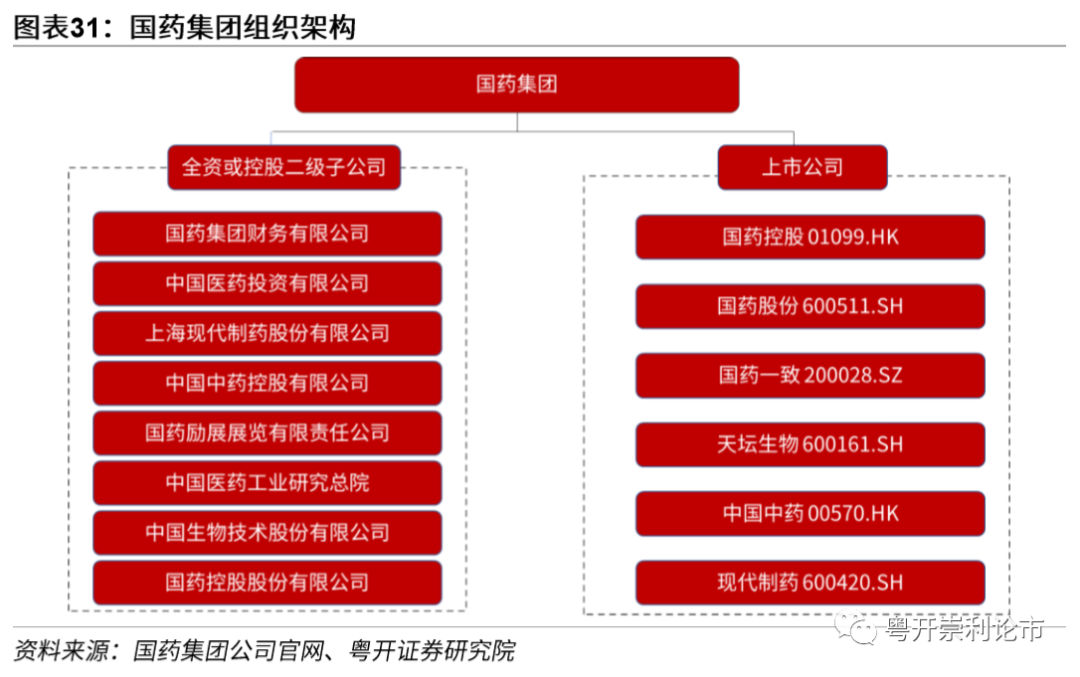
国药集团的灭活疫苗已经提交上市申请。4月12日,武汉生物制品研究所研发的公共卫生事件灭活疫苗获得临床试验批件,并同步开展国内I/Ⅱ期临床试验。4月27日,北京生物制品研究所研发的公共卫生事件灭活疫苗再次获得临床试验批件,为公共卫生事件疫苗的研发加上双保险。国药集团研制的两款公共卫生事件疫苗目前均处于临床Ⅲ期。11月25日,中国国药集团有限公司副总经理石晟怡表示,中国国药集团已向国家药监局提交了公共卫生事件疫苗上市申请。
国药集团公共卫生事件疫苗可有效诱导产生中和抗体。8月13日,国际医学期刊《美国医学会杂志》刊登了国药集团武汉所公共卫生事件灭活疫苗I/Ⅱ期临床试验结果,在I期临床试验中,低、中、高剂量组和铝佐剂对照组共96名志愿者于0/28/56天接受三次接种。Ⅱ期临床试验中,224名志愿者于0/14和0/21天接受两次中剂量接种。结果显示,I期临床中接种三次疫苗后14天,低、中、高剂量的疫苗在志愿者中诱导产生的血清中和抗体几何平均滴数分别为316、206和297,大多数试验参与者在I期试验中第二次注射后开始产生抗体反应,在第三次注射后的14天抗体保持高水平;Ⅱ期临床中0/14和0/21接种两次中剂量疫苗后14天,疫苗在志愿者中诱导产生的血清中和抗体平均滴度分别为121和247。I/Ⅱ期临床试验结果表明国药集团公共卫生事件疫苗可有效诱导产生中和抗体。
阿联酋和巴林针对国药集团的灭活疫苗启动了紧急使用。9月14日、11月3日,阿联酋和巴林分别宣布国药集团公共卫生事件疫苗用于本国紧急使用,阿联酋紧急接种人员包括副总统兼总理阿勒·马克图姆。目前,国药集团的灭活疫苗全球意向订单已超过5亿剂。
(三)腺病毒载体疫苗
腺病毒载体采用基因工程方法构建,以复制缺陷型腺病毒为载体,可表达公共卫生事件病毒S蛋白,用于预防公共卫生事件病毒感染引起的疾病。目前全球共有4款病毒载体疫苗处于临床三期,包括康希诺生物/军事科学研究院开发的Ad5-nCoV、牛津大学/阿斯利康联合开发的ChAdOx1-S、强生研发的Ad26-nCoV和俄罗斯Gamaleya研究中心研发的Ad26+Ad5-nCoV。
1、康希诺生物
康希诺生物股份有限公司于2009年成立于中国天津,致力于为中国及全球公共卫生研发、生产和商业化创新疫苗。公司现有4个创新疫苗平台技术,包括腺病毒载体疫苗技术、结合技术、蛋白设计与重组技术、制剂技术。目前,公司已建立覆盖13种传染病的16种疫苗研发管线,包括2017年获批的重组埃博拉病毒疫苗以及在研的重组公共卫生事件病毒疫苗。
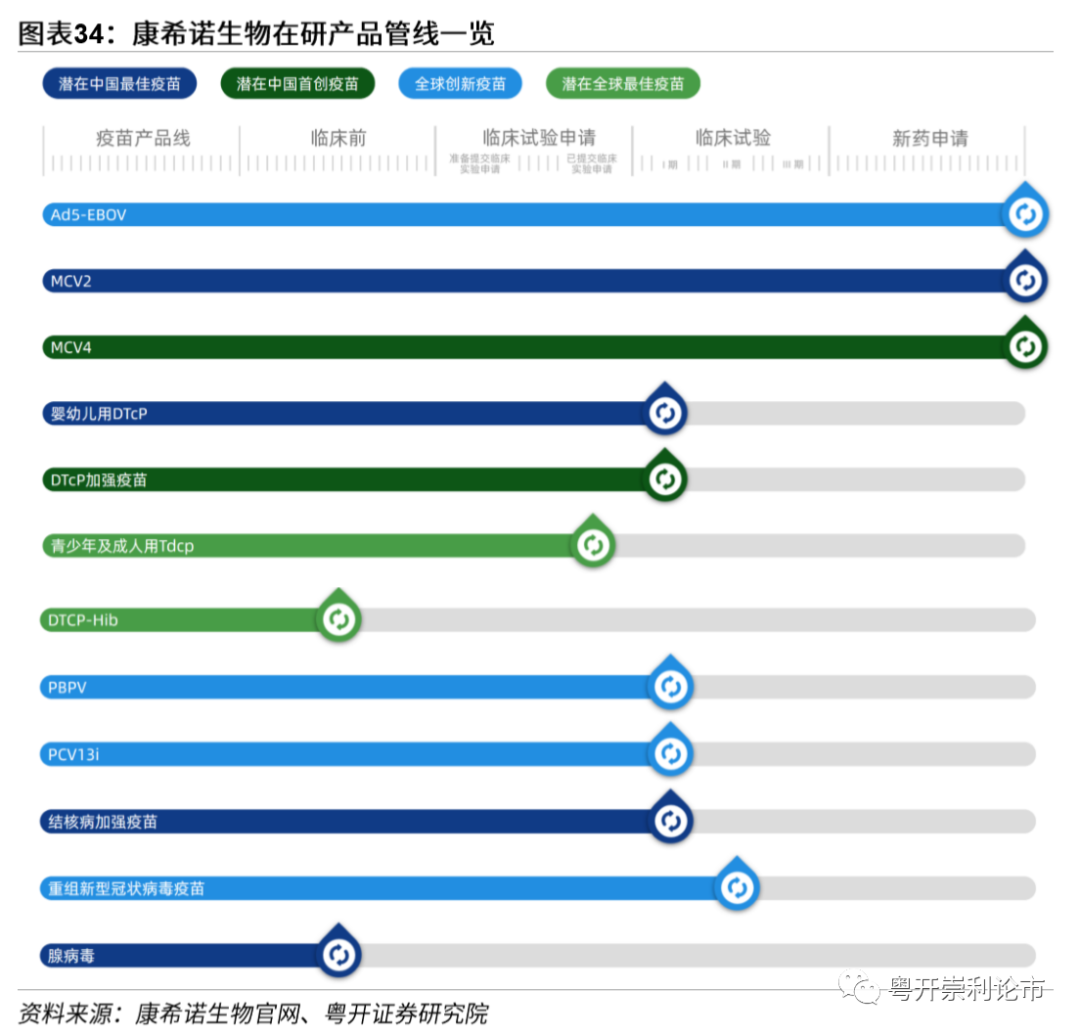
康希诺腺病毒疫苗单针接种可引起体液、细胞双重免疫。3月16日,康希诺和军科院的腺病毒载体公共卫生事件疫苗获批临床。7月21日,公共卫生事件疫苗Ⅱ期实验结果于《柳叶刀》发表,在实验中,508名合格受试者被随机分配入5*1010病毒颗粒低剂量组(250人)、1*1011病毒颗粒中剂量组(125人)和安慰剂组(125人),结果表明低剂量组的ELISA抗体峰值为571,中剂量组的ELISA抗体峰值为656.6,两个剂量组的血清抗体阳转率分别为96%和97%。同时腺病毒载体疫苗载体可以有效激发细胞免疫,低剂量组和中剂量组的IFNγ-ELISpot的反应率分别为90%和88%,细胞免疫可有效清除感染细胞。
康希诺疫苗已于军队中使用,是目前唯一一款单针疫苗。6月25日,腺病毒疫苗获得中央军委后勤保障部卫生局颁发的军队特许药品批件,有效期一年。根据《中国人民解放军实施办法》规定,Ad5-nCoV现阶段仅限于军队内部使用,未经军委后保部批准,不得扩大接种范围。放眼全球,目前康希诺获得墨西哥3500万剂的公共卫生事件疫苗订单。

2、牛津大学/阿斯利康/康泰生物
牛津大学/阿斯利康腺病毒载体疫苗综合有效率达70%。与康希诺团队采用人腺病毒载体不同,牛津大学/阿斯利康采用的为黑猩猩腺病毒载体,通过对黑猩猩腺病毒进行基因改造使之编码人类SARS-CoV-2病毒刺突蛋白。11月23日,阿斯利康宣布Ⅲ期临床中期结果显示,公共卫生事件疫苗对病毒的平均保护效力为70%。70%的保护效力由两种给药方案综合得出,第一项研究方案为,第一针一半剂量,间隔一个月后接受第二针全剂量,有效率达90%(n=2741);第二项研究方案为,两次均为全剂量给药,有效率达62%(n=8895)。两个试验组病人耐受较好,未出现疫苗相关的严重安全问题。

牛津大学/阿斯利康的腺病毒载体疫苗具有保存便捷、价格便宜和老年人耐受等优势。一是可在2-8℃下保存,常规冰箱即可实现;二是在《柳叶刀》发表的Ⅱ期临床试验数据显示,疫苗在老年人中诱导了强烈的免疫应答,与年轻人相比,耐受性更好;三是价格便宜,牛津疫苗仅需2镑/剂,两剂售价4镑,不足人民币40元,这对于全民免费接种的英国和贫穷国家而言,不会造成卫生系统的巨额支出。因此,目前全球对于阿斯利康的疫苗展开大举采购,据nature统计,针对阿斯利康/牛津2021年全球采购量已超过24亿剂。
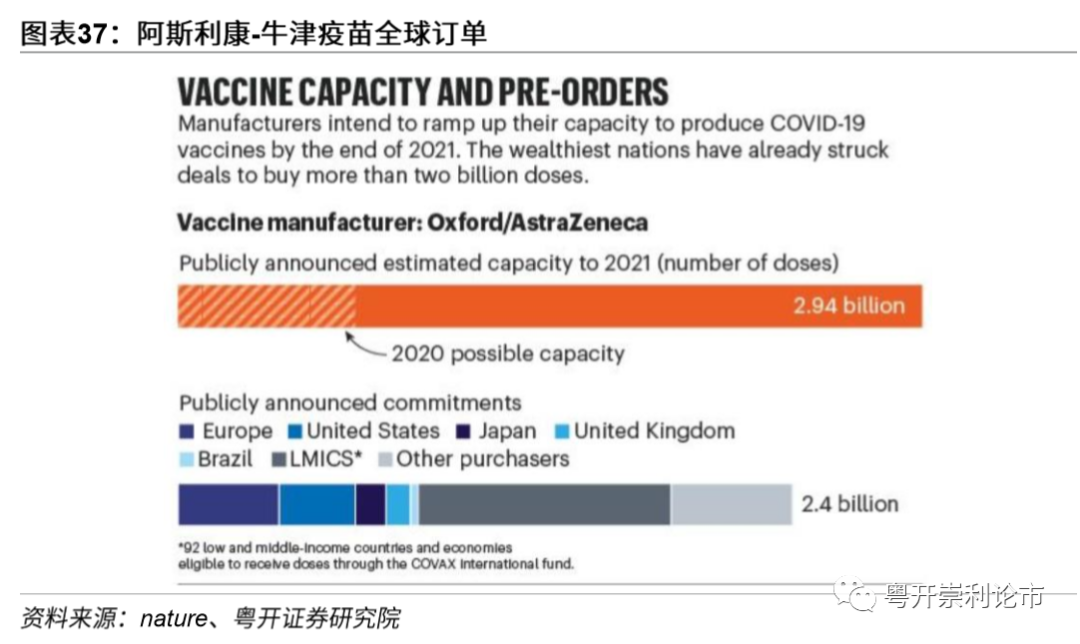
康泰生物负责牛津/阿斯利康疫苗中国区的商业化活动,2021年产能预计达2亿剂。值得一提的是,牛津大学/阿斯利康的腺病毒载体疫苗国内的研发、生产、供应和商业化由康泰生物负责。根据双方8月签订的协议,康泰生物作为技术受让方将确保在2020年底前达到至少1亿剂公共卫生事件疫苗的年产能,并在2021年底将该疫苗产能扩大至2亿剂,以满足中国市场的需求。
(四)重组蛋白亚单位疫苗
重组蛋白亚单位疫苗是将重组工程细胞表达的公共卫生事件S蛋白受体结合区抗原制备成疫苗,把它接种到人体,刺激人体产生抗体。相当于不培养完整病毒,而是单独生产公共卫生事件的关键部件“保护性抗原”,将其交给人体的免疫系统识别,产生免疫力。
智飞生物疫苗12月初进入Ⅲ期临床。12月3日,中国科学院微生物研究所发布公告,生物研究所与智飞生物联合研制的公共卫生事件重组蛋白亚单位疫苗将在18周岁及以上人群中开展随机、双盲、安慰剂对照的国际多中心临床试验,计划在全球招募29000人。得益于智飞生物成熟的重组蛋白技术路线和高表达工程细胞株,智飞生物重组亚单位公共卫生事件疫苗预计年产量达3亿剂。
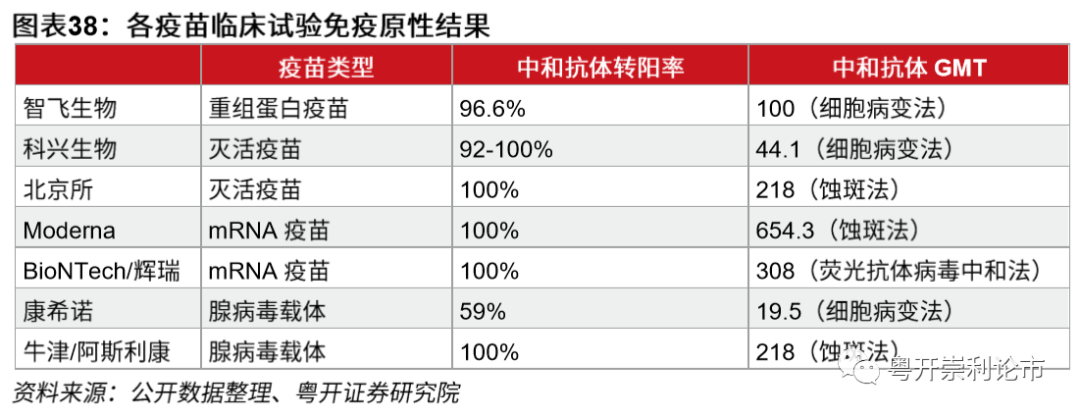
智飞生物的重组蛋白亚单位疫苗安全性和免疫原性较好。根据重组蛋白疫苗Ⅰ、Ⅱ期临床试验,均表现出良好的安全性,没有发现明显不良反应案例。在免疫原性方面,一期临床试验阳转率100%、二期临床试验阳转率96.6%,一期临床试验中和抗体GMT值94.5,二期临床试验中和抗体GMT值超过100。GMT是指抗体滴度,数值越大说明疫苗成份免疫原性越强、意味着保护力越高。
不同方法测算的抗体滴度存在差异。智飞生物重组蛋白公共卫生事件疫苗临床血清测定采用的是细胞病变法。科兴中维和康希诺同样采用细胞病变法测算抗体滴度,前者GMT值为44.1,后者GMT值是19.5。北京所和武汉所的灭活公共卫生事件疫苗采用的是蚀斑法,GMT值分别是218和345;Moderna和辉瑞BiNTech的mRNA公共卫生事件疫苗也是蚀斑法,GMT值分别是645.3和308。由于血清测定方法、参考血清等都不一致,二者之间不具有一定相关性。部分学者的研究表明,蚀斑法值为200的GMT值相当于细胞病变法的23左右。如果这一研究成立,智飞生物重组蛋白公共卫生事件疫苗中和抗体水平或领先于全球。
三、近期疫苗大事推演
12月2日,国务院副总理孙春兰、国务委员王勇在北京调研公共卫生事件疫苗研发和生产准备工作,实地考察中国食品药品检定研究院、北京科兴公司、国药中生北京公司时,强调疫苗工作目前取得重要阶段性进展,下一步要继续科学严谨推进疫苗Ⅲ期临床试验,严格按照法律法规和国际认可的技术标准做好审评审批工作,确保疫苗安全有效、经得起各方面检验。同时要做好大规模生产准备,严格按照质量监管、生物安全等法规、程序和要求,健全疫苗全流程追溯体系,依法严惩违法违规行为,营造良好市场环境。
12月4日,科研公关组疫苗研发专班副组长、中国工程院院士王军志在第八次世界中西医结合大会做《公共卫生事件疫苗和药物研发进展》发言时表示,“关于疫苗,未来一至两周将有大消息公布。年内将有6亿支灭活疫苗获批上市。”
我们认为,无论是国务院副总理的发言,抑或工程院院士公开发表的讲话,均向全国人民传递一个重要信号:国产首款公共卫生事件疫苗即将获批上市,目前正处于冲刺上市的关键时期,下一步的重点工作将重点落实疫苗研发和疫苗产业化的衔接工作。对此,王军志院士透露年内将有6亿支疫苗获批上市,孙春兰副总理强调要做好大规模生产的准备。
国药集团的灭活疫苗或于12月中下旬率先上市。根据王军志院士的发言,疫苗未来一至两周内将有大消息公布。我们认为,考虑到王院士12月4日发表演讲,一至两周的时间将进入12月中下旬,大约为12月11日至12月25日。此外,由于王军志院士强调即将上市的公共卫生事件疫苗为灭活疫苗,目前我国共有三款公共卫生事件疫苗处于临床Ⅲ期,分别是科兴生物的一款公共卫生事件疫苗、国药集团的两款公共卫生事件疫苗。考虑到国药集团的两款公共卫生事件疫苗均于11月底提交上市申请,科兴生物疫苗尚无提交上市申请的动作,我们认为,12月中下旬上市的公共卫生事件疫苗大概率为国药集团的公共卫生事件疫苗。随着公共卫生事件疫苗的上市,国药集团将凭借先发优势,坐拥庞大市场,享受疫苗巨大市场红利。
考虑到2021年国产疫苗产能和出口因素,我国公共卫生事件疫苗市场仍存在巨大空间。即使国药集团的灭活疫苗如我们所预测率先上市,但由于产能无法实现大规模覆盖,后来者的市场依然不容小觑,未来空间值得期待。根据目前5家临床三期企业公布的预产能,2021年国药集团产能8-10亿剂,科兴生物3亿剂,康希诺2亿剂,智飞生物3亿剂。其中国药集团、科兴生物和智飞生物的疫苗均须使用2剂,可覆盖7-8亿人,康希诺的疫苗仅须1剂,可覆盖2亿人,5家公司总产能可覆盖9-10亿人。因此,即使以上疫苗全部用于国内人民,亦无法实现全覆盖。此外,从目前统计的海外订单数量看,接近6亿剂的订单将出口海外,这意味着可用于国内市场的疫苗数量十分有限。因此,我们认为,在未来的数年内,处于公共卫生事件疫苗研发前列的企业将持续受益,包括国药集团、科兴生物、智飞生物、康希诺生物等。
公共卫生事件疫苗以成本作为定价依据,疫苗的价格集中于60-200元/剂。对于公共卫生事件疫苗产品,除了密切关注企业的产能,同时要留意疫苗的最终定价。我国《疫苗管理法》明确规定,当出现特别重大公共卫生事件,由国家卫生健康委提出紧急使用疫苗的申请,由国家药监局组织专家论证并同意,由国家卫生健康委在一定范围、一定时限内紧急使用疫苗。公共卫生事件疫苗属于公共卫生产品,基本原则是定价不能以市场的供需矛盾作为定价依据,只能以成本作为定价依据。对于灭活疫苗,可参考科兴生物在浙江嘉兴200元/剂的售价;对于腺病毒载体疫苗,可参考阿斯利康18元/剂和强生60元/剂的价格;对于重组蛋白疫苗,可参考赛诺菲126元/剂的价格;对于mRNA疫苗,可参考Moderna164-243元/剂和BioNTech117元/剂的售价。因此国产公共卫生事件疫苗的价格将集中于60-200元/剂,以覆盖企业的研发成本、生产成本和物流运输等成本。
四、风险提示
疫苗研发结果不及预期,疫苗价格不及预期,疫苗严重不良反应风险。
(本文编辑:孙健一)



 扫码下载智通APP
扫码下载智通APP