盘点2021第一季度的十大“首个”获批疗法
本文来源微信公众号“药明康德”。
无论对于患者还是研发人员来说,“首个”都具有不同寻常的意义。它可能代表着没有治疗选择的患者获得改善症状和延长生命的希望,也可能代表着更为安全有效的治疗选择。从研发角度来说,“首个”意味着新靶点、新技术以及新治疗模式得到验证,为成功开发未来疗法打开一道道大门。今天,药明康德内容团队将为读者盘点今年第一季度获批的10项“首个”疗法。
Cabenuva:首个FDA批准的长效HIV治疗方案

对于HIV感染者来说,每日服用一片抗病毒药物,虽然能够有效控制病毒,让他们的寿命与健康人没有显著区别,然而如果因为某些原因无法每日服药,体内的病毒不但可能卷土重来,而且产生耐药性的风险也会增加。在治愈性疗法诞生之前,每日服药对于很多HIV感染者来说仍然是一个负担。
今年一月,FDA批准ViiV Healthcare公司的Cabenuva上市,这是首款获得FDA批准的长效HIV注射疗法,只需每月给药一次就能够达到抑制病毒的效果,大幅度减轻了患者服药的负担。而且ViiV Healthcare公司进行的临床试验已经证明,每隔两个月接受一次Cabenuva治疗的效果与每隔一个月接受一次治疗的效果相当。该公司已经向FDA递交监管申请更新用药间隔。未来,HIV患者有望将每年服药次数从365次缩减为6次。
日前,吉利德科学(GILD.US)公司和默沙东(MRK.US)也达成协议,将联合两家公司的潜在“first-in-class”疗法开发长效注射和口服HIV疗法。HIV患者有望迎来更多便捷有效的治疗选择。
Lupkynis:首个治疗狼疮性肾炎的口服创新疗法

狼疮性肾炎是自身免疫性疾病系统性红斑狼疮(SLE)最严重、最常见的并发症之一。它引起不可逆的肾脏损害,显著增加肾衰竭、心脏事件和死亡的风险。
Lupkynis是一种潜在“best-in-class”的新型钙调磷酸酶抑制剂(CNI)。它通过抑制钙调磷酸酶,阻断IL-2表达和T细胞介导的免疫反应,稳定肾脏足细胞(podocyte)。包含357名LN患者的关键性3期临床试验结果表明,Lupkynis达到40.8%的完全肾脏缓解率(complete renal response rate),对照组这一数值为22.5%(p<0.001)。
狼疮性肾炎患者在经过漫长的等待后,在短短两个月内迎来了首款获得FDA批准的生物制品疗法Benlysta和首款口服疗法Lupkynis。它们代表着治疗狼疮性肾炎领域的重大进步。
Pepaxto:首个FDA批准的抗癌肽偶联药物

多肽类药物的分子量介于小分子药物和生物制品之间,与生物制品相比,多肽具有多种优点:它们的设计更简单、能与未充分探索的靶标相互作用、具有更低的的免疫原性和更好的组织渗透性。除了具有生物活性外,肽还能很好地将药物运送到特定的靶标。今年3月,美国FDA加速批准Oncopeptides的抗癌肽偶联药物Pepaxto上市,与地塞米松联用,治疗复发/难治性多发性骨髓瘤(MM)成年患者。显示了这一治疗模式在治疗癌症方面的潜力。
Pepaxto通过将烷化剂与靶向氨肽酶的多肽偶联在一起,能够迅速被MM细胞摄入。它能够提高烷化剂在细胞内的浓度,杀伤MM细胞的能力比其携带的烷化剂高50倍。
与抗体偶联药物相比,肽偶联药物需要解决的额外挑战是如何克服多肽由于分子量较小,导致药物在血液循环中稳定性较差,容易被肾脏清除的问题。在这一领域,目前已经有多种技术来提高多肽的稳定性,包括将多肽进行环化,以及不同的化学修饰和纳米技术。除了Oncopeptides公司,Bicycle Therapeutics公司也有多款治疗癌症的肽偶联药物处于临床开发阶段。
Entresto:首个FDA批准治疗射血分数保留性心力衰竭患者的药物

心力衰竭是一种常见且非常严重的慢性心血管疾病,影响全球超过6000万人。在中国的心衰患者也超过1370万。心衰可以分为射血分数保留性(HFpEF)和射血分数降低性(HFrEF)两种类型。虽然多款创新疗法近年来获批治疗HFrEF,但是占慢性心衰患者总数接近一半的HFpEF此前没有FDA批准的疗法。
这一状况在今年2月得到转变,美国FDA批准诺华公司的重磅心衰药Entresto(沙库巴曲/缬沙坦,中文商品名诺欣妥)用于治疗HFpEF患者。Entresto由脑啡肽酶抑制剂沙库巴曲和血管紧张素受体拮抗剂缬沙坦结合而成,两者结合能更好地发挥有益作用。
对于因为症状不符合HFrEF类型而不能接受治疗的上百万心衰患者来说,这一批准为他们带来了急需的治疗选择。
Evkeeza:首个靶向血管生成素样蛋白3的获批疗法

今年2月,FDA批准再生元公司(REGN.US)的降脂疗法Evkeeza(evinacumab-dgnb)上市,与其它降低低密度脂蛋白胆固醇(LDL-C)的疗法联用,治疗12岁以上纯合子家族性高胆固醇血症(HoFH)患者。Evkeeza是首个FDA批准的阻断血管生成素样蛋白3(ANGPTL3)功能的靶向疗法。它的获批不但展示了ANGPTL3这一靶点在治疗心血管疾病方面的潜力,也进一步验证了利用人类遗传学研究,发现和验证在研靶点这一研发策略的可行性。
ANGPTL3是肝脏分泌的一种蛋白,在调节甘油三酯和胆固醇水平上具有关键性作用。人类遗传学研究已经表明,由于基因突变导致ANGPTL3功能丧失的个体,心血管疾病风险可以降低约40%。Evkeeza通过与ANGPTL3结合并阻断其功能,在临床试验中能够将LDL-C水平降低49%。
如今多家生物医药公司在开发靶向ANGPTL3的创新疗法,包括Ionis Pharmaceuticals, Arrowhead Pharmaceuticals, Verve Therapeutics公司等等。
Keytruda:首个一线治疗食管癌的免疫疗法
食管癌是世界范围内导致癌症死亡的第6大原因,然而近30年来患者的一线治疗选择仍然是手术治疗和化学放射治疗。今年3月,美国FDA批准默沙东的重磅PD-1抑制剂Keytruda(帕博利珠单抗)与含铂和氟嘧啶化疗联用,一线治疗局部晚期或转移性食管癌或胃食管连接部(GEJ)腺癌患者。这是首个获得FDA批准用于一线治疗这一患者群的抗PD-1免疫组合疗法。
此外,百时美施贵宝(BMY.US)公司开发的PD-1抑制剂Opdivo在作为手术后辅助疗法,在治疗食管癌时能够将患者的无病生存期延长一倍,它也有望在今年夏天获批,革新食管癌患者的辅助治疗选择。
癌症免疫疗法目前越来越多地获得批准治疗早期癌症患者,让它们能够为更多患者造福。
Abecma:首个治疗多发性骨髓瘤的细胞疗法

今年3月底,FDA批准百时美施贵宝和bluebird bio联合开发的靶向B细胞成熟抗原的嵌合抗原受体(CAR)-T细胞免疫疗法Abecma(idecabtagene vicleucel)上市,用于治疗已经接受过四种以上前期疗法的复发/难治性多发性骨髓瘤(R/R MM)成年患者。这是首款用于治疗MM患者的细胞疗法,也是首款获得批准靶向BCMA的细胞疗法。
虽然有多种疗法可以治疗MM患者,但是MM仍然属于一种无法治愈的血液癌症,患者在获得缓解之后会对疗法产生耐药性,从而疾病复发,很多患者最终会对所有获批疗法产生耐药性。Abecma的获批为这些患者提供了一个新的治疗选择。它通过在从患者体内获得的T细胞上表达靶向BCMA的CAR,将它们变为杀伤癌症的细胞武器。在临床试验中,Abecma达到72%的总缓解率,28%的患者达到严格的完全缓解。
CAR-T疗法在治疗血液癌症方面已经表现出革命性的潜力,Abecma是FDA批准的第5款CAR-T疗法,也是首个获批靶向CD19抗原之外的CAR-T疗法。Informa公司旗下Pharmaprojects发布的2021医药研发年度报告(the Pharma R&D Annual Review 2021)显示,全球研发管线中有612款CAR-T疗法,自在2017年首款CAR-T疗法获批以来,CAR-T领域有望迎来获批疗法的爆发。
Acuvue Theravision+ketotifen:首款获批治疗眼睛过敏的隐形眼镜

上周,强生公司(JNJ.US)旗下的Johnson & Johnson Vision宣布,日本厚生劳动省(MHLW )已经批准该公司能够释放药物的隐形眼镜Acuvue Theravision + ketotifen上市。这种隐形眼镜包含酮替芬(ketotifen),它是一种抗组胺药物,能够治疗与眼睛过敏相关的眼痒。这是全球范围内首款获得监管机构批准上市的药物释放隐形眼镜,代表着这一眼科药物创新递送技术的重要突破。
隐形眼镜自从在上世纪60年代问世以来,就成为科学家们研究的眼科药物递送方式。通过隐形眼镜递送药物的优势在于因为它们长时间佩戴在眼睛上,释放的药物在眼中存留时间显著延长,能够更好地发挥药物的作用。同时,患者不用多次接受治疗,避免了因为忘记滴眼药水而影响药物疗效的问题。
强生公司开发的这款隐形眼镜在两项3期临床研究中获得了积极的治疗效果。在佩戴释放药物的隐形眼镜的患者中,戴上隐形眼镜15分钟后就能够观察到显著降低眼痒的效果。而且这一效果可以持续12个小时。
目前,隐形眼镜释放药物技术已经能够容纳和释放多种药物类型,包括抗生素、类固醇、免疫抑制剂、抗炎症药物等等。它们不但可能用于眼科手术后的短期护理,还可能为治疗青光眼、干眼病等慢性眼科疾病提供更便捷有效的治疗手段。
Nulibry:首个FDA批准治疗A型钼辅因子缺乏(MoCD)症的疗法

对于罕见病患者来说,不但确诊难,找到有效的治疗方法更难。A型钼辅因子缺乏(MoCD)就是这样一种疾病。由于基因变异导致钼辅因子合成中断,具有神经毒性的代谢物在身体中积累,导致严重脑病和顽固性癫痫发作。患者通常在婴儿时就会去世,即便生存超过最初几个月的患者也会出现大幅度发育迟缓,并遭受不可逆的神经损伤。
今年2月FDA批准的Nulibry(fosdenopterin)是首款治疗这些患者的创新疗法,它是一款“first-in-class”cPMP氢溴酸盐二水合物,可以替代cPMP并允许钼辅因子的合成步骤继续进行,在激活钼辅因子依赖性酶的同时消除有毒代谢物。
Nulibry也反映了医药行业和监管机构对罕见病疗法的重视,FDA近年来批准的创新疗法中,罕见病疗法的比例不断升高。日前发布的2021医药研发年度报告显示在2021年初,全球研发管线中有5608种不同的罕见病疗法开发项目,增长幅度超过了研发管线的整体增长幅度。648种罕见疾病目前有针对性的研发项目,与上一年相比增长了40种,增长幅度达到2014年以来的新高。
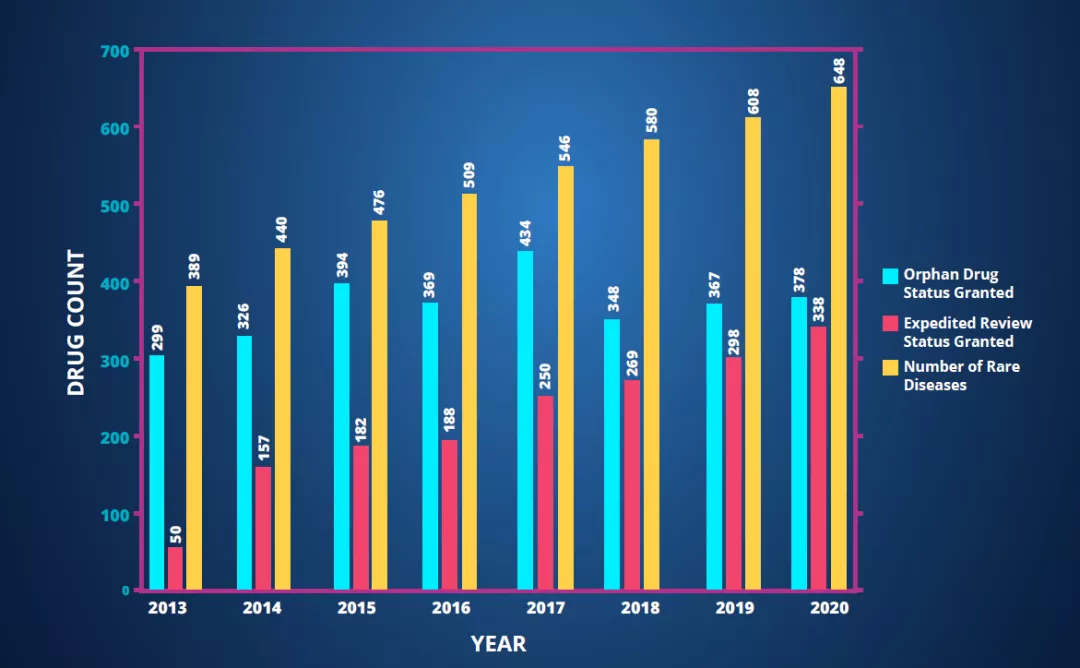
▲2013年以来罕见病药物管线发展趋势
Ad26.COV2.S:美国FDA授予紧急使用授权的首个单剂新冠疫苗
强生的Ad26.COV2.S新冠疫苗是一款使用腺病毒载体表达新冠病毒刺突蛋白的疫苗。它的特点在于一次接种之后就可以提供对COVID-19的保护能力,在临床试验中,接种14天后预防COVID-19的效力为67%。而且它在-20℃下的稳定性长达2年,在2-8℃下也能够保持3个月的稳定性。因此,在疫苗的存储、运送和分配上均能够使用目前的标准渠道,在大流行情况下对提高新冠疫苗的可及性非常重要。
在新冠疫情爆发后不到一年半的时间里,生物医药产业已经开发出多款高效新冠疫苗,在世界各地获得授权广泛使用,这不但体现了像mRNA疫苗这样的新技术平台的潜力,也彰显了生物医药界在面对大流行时齐心协力,合作创新的努力。
我们期待在2021年迎来更多“首个”疗法,为患者带来创新治疗选择,也希望这些“首个”疗法的成功能够铺平让治疗疾病的疗法从“首个”变为“多个”的道路,造福更多患者。
(智通财经编辑:陈秋达)



 扫码下载智通APP
扫码下载智通APP