AD终获批,阿尔兹海默症概念或得到资金洗礼
当我们还在津津乐道各省高考作文题目时,百健(BIIB.US)终于搞出一个“诺贝尔”的消息。
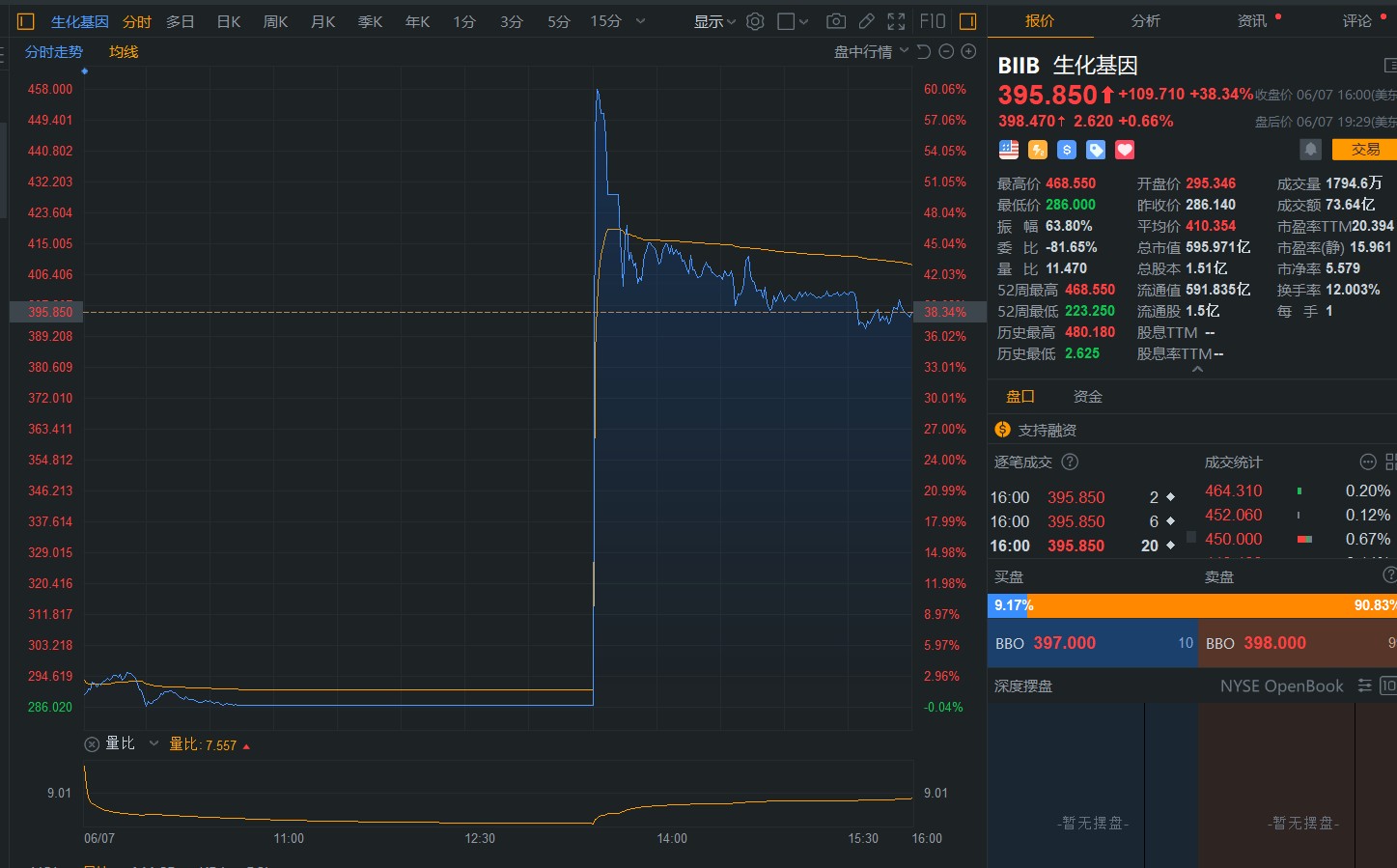
6月7日晚间,FDA宣布批准百健/卫材公司Aβ(β淀粉样蛋白)抗体 Aduhelm (aducanumab) 用于治疗早期阿尔茨海默症(AD)患者的生物制品许可(BLA)申请。消息传出后,百健一度暴涨近60%,触发两次熔断,最终收涨38.34%,报395.85美元。
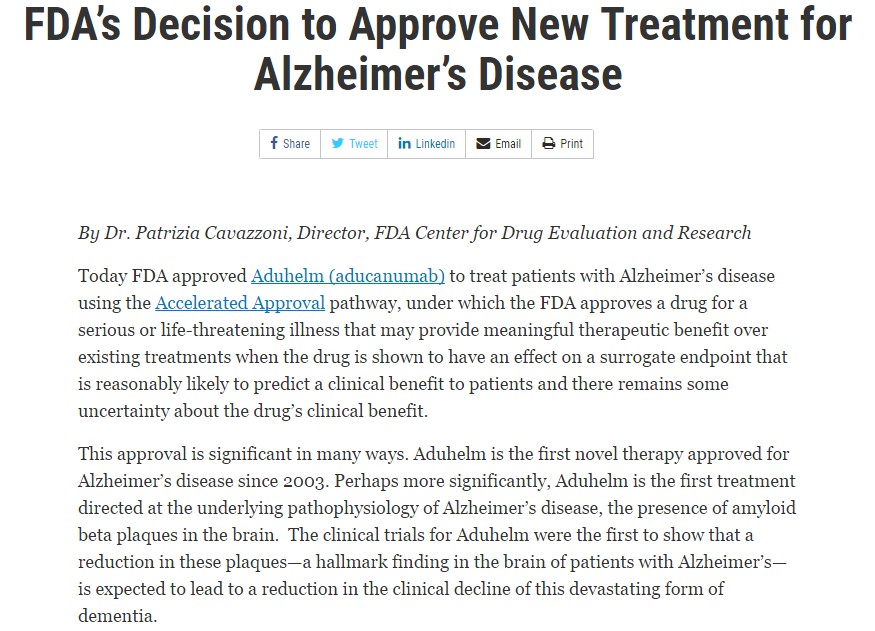
与之同时,FDA也将批准的详细声明得到了公示。
其在声明中表示,重点强调了这一批准在诸多方面都是很重要的。Aduhelm是首个针对阿尔茨海默病潜在病理生理学的治疗药物,即大脑中存在β淀粉样蛋白斑块。Aduhelm的临床试验首次表明,这些斑块的减少有望导致这种毁灭性的痴呆症临床衰退的减少。
智通财经APP观察到,在确定该申请符合加速批准的要求时,FDA得出结论,Aduhelm对阿尔茨海默病患者的益处超过了该疗法的风险。同时,FDA还表示,Aduhelm的后期开发计划包括两项3期临床试验:一是研究达到了主要终点,显示临床检测认知水平的指标下降速度减缓。二是试验未达到主要终点。但另外,FDA最后还是非常严谨地表态,如果确证性试验未验证药物的预期临床获益,将制定可能导致药物从市场上撤出的监管程序。
不管如何,Aduhelm的获批就阿尔茨海默症而言,无疑具有划时代意义。
Aduhelm获批一波三折
事实上,百健/卫材的Aduhelm的获批充满了离奇。
智通财经了解到,2007年,百健花费3.8亿美金从一家瑞士公司手里买入Aducanumab。之所以14年期拆巨资买入,是其发现这种药物,很像人体免疫系统生产出来的、能够精确识别和对抗入侵者的抗体蛋白质分子。Aducanumab这把叉子能够精确地识别和结合人体当中产生的一个名叫A-beta的蛋白质聚合体。
而A-beta这种蛋白质恰巧是阿尔茨海默症研究的焦点,因为研究员们认为,人脑中这种异常蛋白的出现、聚合和沉淀,是阿尔茨海默症发病的罪魁祸首,因此清除了A-beta物质,就能“克服”阿尔茨海默症。

后面随着研究的深入,这一猜想也逐渐得到验证。2015年,100多位受试者的早期临床试验结束,结果显示,Aducanumab能够持续减少淀粉样蛋白沉积,并且可能延缓阿兹海默病患者的认知能力衰退。
受益数据,2017年,百健与卫材一起在全世界范围内开展了两项大规模的临床研究,计划在18个月的时间里,召集数千位患者,给他们用药,长期追踪疾病情况,来证明Aducanumab的安全性和药效。
两年不到,试验进展已经过半,可黑天鹅却悄然而至。依据当时现有数据,他们却发现了重大问题:该药物对于阿兹海默症及其引发的轻度认知损伤没有改善作用,简而言之“这药没有用”。这一问题可谓“足以杀死自己。”
因为百健随着Aducanumab研究的深入,早已将产品线定位于高风险的神经退行和中枢损伤疾病,过去几年除了SMA药物SPINRAZA之外几乎全部失败,而这个产品也面临基因疗法和小分子药物的威胁。虽然百健花高价摆平了最重要上市产品富马酸二甲酯(商品名Tecfidera)的专利威胁,但MS领域竞争也相当激烈,其它机理新药不断出现。若Aducanumab也宣告失败,百健的苦日子可想而知。
不过,最后百健还是大方承认了自己失败,同时也宣布终止这个药物的二期临床Evolve和另一个长期试验Prime。2019年3月22日,其股就就跳水29%,市值蒸发170亿美元。
当然,短期失败不意味着结束,在拿到之前积累的数据后,发现接受了较高药物剂量(10mg/kg,)的人群组结果有些不一样,似乎有一点作用。于是再次进行试验,只不过采取分组——高、低剂量用药。结果仍旧显示,高剂量用药的结果是较好;低剂量则出现轻微的恶化。
同年10月22日,其宣布“成功”,百健股票在纳斯达克开盘前大幅上涨40%左右。
2020年,百健准备“交卷”。11月份,FDA也公开了内部专家对百健/卫材粉状蛋白抗体aducanumab的上市申请给出非常积极的评价,说临床数据非常有说服力、并否认脑水肿副作用起到揭盲作用。
让智通财经APP意外的是,其中一个统计学家提出不同意见,认为即使高剂量组也证据不够完善。今天在外部专家组讨论会上FDA神经药物负责人的讲话有点站台过度嫌疑,令专家质疑其动机。最后专家组以8票反对、1票赞成、2票不确定否认adu的Emerge试验证明这个药物在中轻度AD患者的疗效,7:0:4否认一期临床103试验的数据。另外几个问题也是负面回答,如10:1质疑把Emerge作为主要证据的合理性。
无奈,Aduhelm被否。
好事多磨,今年6月7日,FDA终于重新批准 Aduhelm用于治疗早期阿尔茨海默症患者的生物制品许可申请。
阿尔茨海默症从不缺玩家
百健如此“渡劫”也要推进 Aduhelm ,其实这均是市场前景的驱使。
世界卫生组织(WHO)估计,全世界包括阿尔茨海默病在内的痴呆症患者已经达到了5000万,预计到2050年这一数字将增加至1.52亿。中国是世界上痴呆症最多的国家,已经超过1000万人,并且患病率呈增长趋势。
《柳叶刀-神经病学》一项研究显示,1990年至2016年,中国60岁以上痴呆症患病率增长了5.6%,远高于全球平均水平1.7%。据推算,到2050年我国包括阿尔茨海默病患者将达到2800万。中国老年协会今年5月份也发出报告,2030年我国阿尔茨海默病患者预计达到2220万。
市场肉眼可见,各制药公司也趋之若鹜。
智通财经APP发现,截止目前,FDA批准上市的5款治疗阿尔兹海默症的药物,主要包括1993年9月批准的盐野义所有的他克林;1996年11月批准卫材的多奈哌齐;1998年5月批准的诺华的卡巴拉汀;2001年2月批准的强生加蓝他命,以及2002年5月的德国麦氏大药厂的美金刚。
当然,除外资企业外,国内也有众多在研企业。
比如2019年CFDA批准的由上海药物研究所、中国海洋大学和上海绿谷制药共同研发的全球首个糖类多靶治疗阿尔兹海默病的创新药物——GV-971。而A股上市公司则包含京新药业、康弘药业等。

港股同样也有多家上市公司启动了阿尔兹海默症的研究。比如2017年,AC Immune SA (ACIU.US)在有5个治疗神经退化性疾病的产品已进入临床阶段,其中针对阿兹海默病的治疗产品,除Crenezumab之外,公司另一产品Anti-Tau也于2017年进入二期临床的背景下,与亿胜生物科技 (01061) 订立研究合作协议,宣布共同开发治疗阿兹海默症及额颞叶痴呆症等神经性疾病的重组蛋白临床治疗药物。
2020年2月,四环医药(00460)发布公告该公司开发的重酒石酸卡巴拉汀胶囊及左乙拉西坦片已获得国家药品监督管理局颁发的药品生产批件,咪达唑仑口颊黏膜溶液则获得药品注册批件。四环医药为中国首家获得咪达唑仑口颊黏膜溶液注册批件的企业。
2月,中国医疗集团(08225)发布公告,该公司负责的临床研究开发服务喜恩卡片剂(重酒石酸卡巴拉汀片剂)和重酒石酸卡巴拉汀原料药均获得国家药品监督管理局注册批准,其中用于轻、中度阿尔茨海默型痴呆的喜恩卡片是全球第一个上市的片剂。
2020年7月石药(01093)发布公告,本公司附属公司石药集团欧意药业有限公司开发“盐酸美金刚片(5mg、10mg)”已获中国国家药品监督管理局颁发药品注册批件,并视同通过仿制药质量和疗效一致性评价。盐酸美金刚为神经系统用药,适用于治疗中重度至重度阿尔茨海默型痴呆。
2020年9月,绿叶制药(02186)公告表示,该公司用于治疗老年性痴呆的在研新药利斯的明透皮贴剂(多日贴)(LY03013)已获国家监督管理局药品审评中心批准启动临床试验。
据了解,利斯的明透皮贴剂(多日贴)为针对中枢神经系统疾病的重点产品,由该公司德国子公司Luye Pharma AG的透皮贴剂研发平台开发,该产品及其制剂工艺受到多个专利的全球保护。Luye Pharma AG是欧洲最大的独立透皮系统制造商之一,拥有工艺高度复杂、技术壁垒高的透皮制剂制造车间,已通过美国、欧盟和日本良好制造规范(GMP)检查。
面对如此大的市场和Aduhelm获批带来的历史冲击,阿尔兹海默症概念显然有望得到资金的洗礼。(田宇轩/文)



 扫码下载智通APP
扫码下载智通APP