透视CAR-T百亿市场 复星医药(02196)联手Kite争份额
本文选自“平安证券研究报告”,作者魏巍、叶寅。
智通财经APP获悉,平安证券发表研究报告指出,首个CAR-T疗法临床申报,按照治疗类生物制品1类/新药进行申报,并纳入优先审评,是一系列药审政策改革在细胞治疗领域的落实,尤其细胞治疗政策正式出台的核心是,紧抓安全+弹性审查,这是对国内细胞治疗行业的规范和鼓励,将开启发展的新纪元。
目前已有多个CAR-T疗法临床申请获CFDA受理。平安证券从临床数据、研发管线、生产工艺以及适应症的市场空间四个角度对重点公司进行对比分析,强烈推荐:安科生物、复星医药。由于安科生物、佐力药业不属于港股公司,本文将省略其内容。
细胞治疗政策正式出台,打开百亿级别新市场
1 细胞治疗政策正式出台,核心:紧抓安全+弹性审查
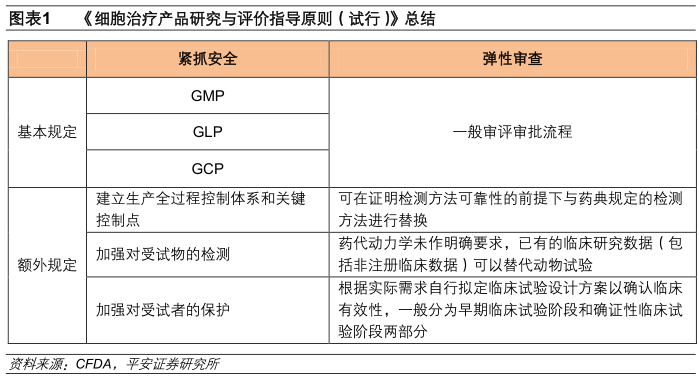
2017年12月22日,CFDA正式发布了《细胞治疗产品研究与评价指导原则(试行)》,对细胞治疗产品在药学研究、非临床研究和临床研究斱面进行了规范,我们认为核心是,紧抓安全+弹性审查,这是对国内细胞治疗行业的规范和鼓励,将开启发展的新纪元。
紧抓安全
指导原则在药学研究、非临床研究、临床研究中对人员、环境、设备和细胞产品都提出相应要求。在药学研究阶段的《药品生产质量管理规范》(GMP),非临床研究阶段的《药物非临床研究质量管理规范》(GLP),临床研究阶段《药物临床试验质量管理规范》(GCP)的基础上,CFDA强调了细胞治疗产品应建立生产全过程控制体系和关键控制点,加强对受试物的检测和对受试者的保护。
在上市后,细胞治疗产品除了常规检查外,还需要关注重要生物学过程的改变,包括免疫应答、免疫原性、感染以及恶性转化等。与小分子药物、大分子生物药物相比,细胞治疗产品在生产、使用和预后中都受到了更多的要求和监管,体现出CFDA对于细胞治疗产品安全性的重视。
弹性审查
在安全性的前提条件下,由于细胞治疗产品作为一种新型的治疗药物,CFDA也给予了较大的审查弹性。在产品质量的检测中,细胞治疗产品可在证明检测斱法可靠性的前提下与药典规定的检测斱法进行替换;在药品申报流程中,对药代动力学未作明确要求,同时细胞治疗产品已有的临床研究数据(包括非注册临床数据)可以替代动物试验;在临床研究中,申请人可以根据实际需求自行拟定临床试验设计斱案以确认临床有效性,一般分为早期临床试验阶段和确证性临床试验阶段两部分。
总体说来,CFDA的指导文件对于细胞治疗产品的申报持更加开放的态度,通过不断鼓励申请人与监管部门的交流,加强各斱对以CAR-T疗法为代表的细胞治疗产品的认识理解和创新。
2 首个CAR-T疗法临床申报,并纳入优先审评
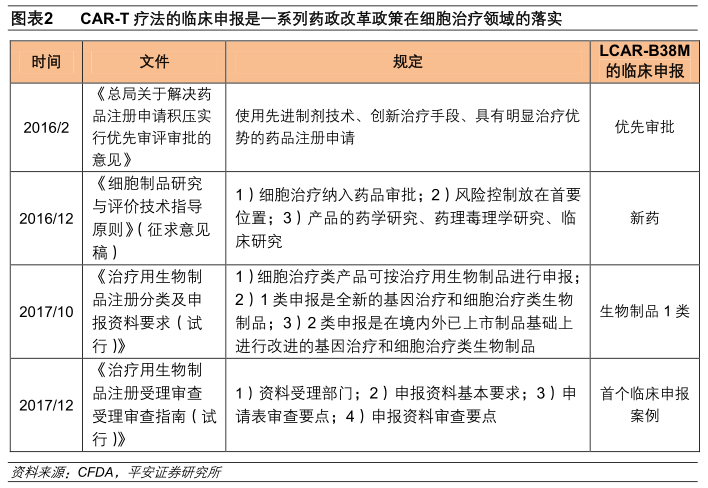
南京传奇生物的LCAR-B38M作为首个CAR-T疗法临床申报,按照治疗类生物制品1类/新药进行申报,并纳入优先审评,是一系列药政改革政策在细胞治疗领域的落实。
2016年2月,CFDA发布了《总局关于解决药品注册申请积压实行优先审评审批的意见》,将使用先进制剂技术、创新治疗手段、具有明显治疗优势的药品注册申请列入优先审评审批的范围,此次LCAR-B38M符合优先审评审批的条件。
2016年12月,CFDA出台了《细胞制品研究与评价技术指导原则》(征求意见稿)明确了将细胞治疗纳入药品审批并提出要将风险控制放在首要位置,同时对该类产品的药学研究、药理毒理学研究、临床研究均做出了规范性指导,此次LCAR-B38M就是按照新药进行临床申报的。
2017年10月,《治疗用生物制品注册分类及申报资料要求(试行)》中明确了细胞治疗类产品可按治疗用生物制品进行申报,其中1类申报是全新的基因治疗和细胞治疗类生物制品(例如创新机理、新载体、新靶细胞等),2类申报是在境内外已上市制品基础上进行改进的基因治疗和细胞治疗类生物制品。此次LCAR-B38M就是按照治疗类生物制品1类进行申报(BCMA是新靶点)。
2017年12月1日,《治疗用生物制品注册受理审查受理审查指南(试行)》中明确了资料受理部门、申报资料基本要求、申请表和申报资料审查要点等,为临床申报提供了有效指导。此次LCAR-B38M正是在该指南的指导下进行的临床申请。
3 CAR-T疗法审批监管借鉴:美国分层监管模式
正常而言,药物上市要经过临床前研究-IND申请-临床试验-NDA申请-生产许可证-GMP认证等过程。诺华CTL019的IND申请时间为2014年7月,上市时间为2017年10月,也就是说诺华的CAR-T产品从临床试验到上市只花了3年多的时间,这对于传统药物而言,审批速度简直不可想象,这充分展示了FDA对CAR-T疗法审批的重视和创新。
对于我国目前的审批监管,或许可以从美国“分层模式”细胞治疗监管措施上得到新的启发。
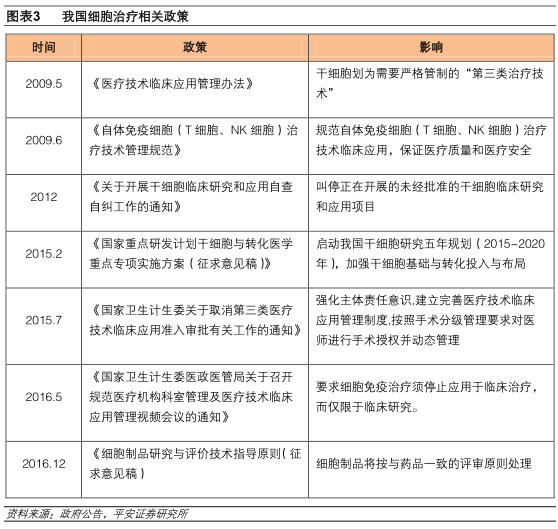
FDA对细胞制品实行的是基于风险的“分层模式”:两大基本原则是干扰最小化和作用同源性,通过评估细胞产品的安全性与毒副作用将细胞产品分为低危高危两种,高危组按照美国公共卫生服务法(PHS)351条进行监管,即按照药品的审评程序;低危组则按照PHS361条进行监管,不需要进行IND申请。CAR-T疗法属于高危组,按照新药审批程序。
此外,FDA不断和相关制药企业和研究机构进行沟通,据此制定了多达数十项有关细胞治疗的指南。这些指导原则为专家评估提供了参考,也为产品的研发和质量控制提供了指导。
4 首个国家转化医学中心开放,利于CAR-T临床研究
2017年11月9日,瑞金医院血液科转化医学病房开始接受首批患者,这个转化医学病房将集中开展CAR-T细胞免疫治疗为代表的临床医学研究。
瑞金医院转化医学中心是我国首个国家级转化医学中心,也将成为我国目前唯一获批的综合性国家级转化医学中心。多年来,瑞金医院血液科已经开展了大量临床试验,其中国际多中心临床试验23项,国内临床试验13项。
瑞金医院血液科转化医学病房将主要收治血液系统恶性肿瘤,首批开发床位18张。瑞金医院为对接CAR-T细胞免疫治疗等前沿治疗技术,升级了相关病例管理,确保治疗安全,目前建成了应对各类可能不良反应的多学科应对策略,设计临床试验的团队也直接进驻病房。
5 仅血液瘤市场达到百亿级别,实体瘤高达千亿规模
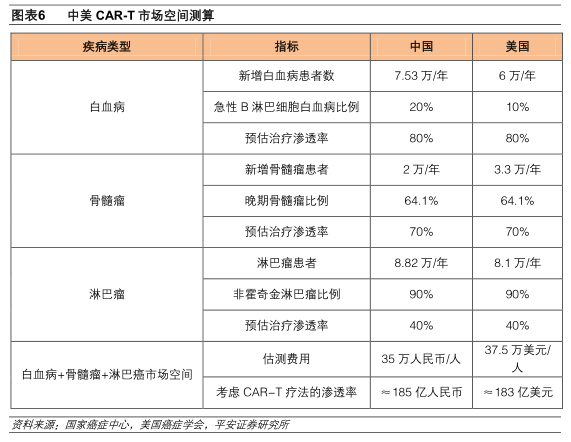
假设治疗费用35万元(参考诺华Kymriah美国定价47.5万美元和KiteYescarta美国定价37.5万美元,按中美之间的人均GDP比例进行转换)),考虑CAR-T疗法渗透率,我国每年新增血液瘤的市场空间总计约185亿元:
2015年我国新增白血病患者人数为7.53万人(急性B淋巴细胞白血病比例为20%),其中急性淋巴细胞白血病的一线疗法为化疗和骨髓移植,但是化疗疗效不持久,骨髓匹配也比较有限,而CAR-T疗法对急性淋巴细胞白血病的疗效非常好,因此预估治疗渗透率80%;
骨髓瘤2.8万人,骨髓瘤目前还无法治愈,常用的来那度胺等药物只能延长患者的无进展生存期(PFS),国外临床试验显示CAR-T疗法对骨髓瘤疗效显著,94%(33/35)的患者在CAR-T治疗2个月后获得了非常好的部分缓解(VGPR),74%(14/19)的患者在4个月后达到了严栺意义的完全缓解(sCR),因此我们预估骨髓瘤的CAR-T疗法治疗渗透率70%;
淋巴癌患者8.82万人(非霍奇金淋巴瘤比例为90%),其中非霍奇金淋巴瘤的一线用药是利妥昔单抗+化疗,疗效较好,出现复发或转移的比例在40%左右,预估CAR-T治疗渗透率为40%。
按照37.5万美元(Yescarta美国定价)完成整个疗程计算,考虑CAR-T疗法渗透率,美国每年新增患者采用CAR-T治疗的市场空间总计可达约183亿美元:
2015年美国新增白血病患者6.01万人(急性B淋巴细胞白血病比例为10%),排除化疗和骨髓移植治疗后治愈或死亡病例,我们预估CAR-T疗法在白血病领域的治疗渗透率为80%;
骨髓瘤患者3.3万人,由于CAR-T疗法治疗骨髓瘤疗效显著,因此我们预估CAR-T疗法的治疗渗透率为70%;
淋巴瘤8.1万人(非霍奇金淋巴瘤比例为90%),一线疗法(利妥昔单抗+化疗)治疗后复斱转移率为40%左右,因此我们预估非霍奇金淋巴瘤的治疗渗透率为40%。
南京传奇生物:国内首家申报CAR-T临床
1 LCAR-B38M疗效显著,与制药巨头杨森强强联合
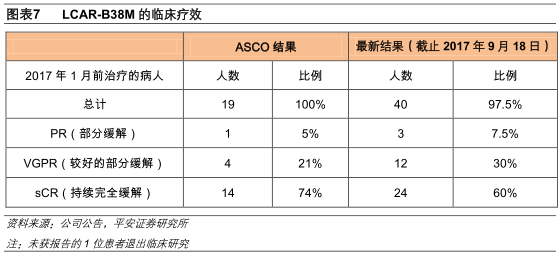
南京传奇生物是金斯瑞生物的全资子公司,LCAR-B38M是靶向于BCMA的一款CAR-T疗法,在2017年6月的美国ASCO会议上,LCAR-B38M以治疗多发性骨髓瘤客观缓解率达到100%的突破性疗效,成为跻身世界一流梯队的CAR-T疗法。2017年12月11日,LCAR-B38M按照治疗类生物制品1类/新药进行临床申报获CFDA受理,并于12月18日被CDE纳入优先审评。
12月22日,传奇生物与JanssenBiotech(杨森)达成全面合作,共同面向全球开发、生产及商业化推广LCAR-B38M。杨森将支付3.5亿美元的首付款项获得授权,在大中华地区,两家以70/30的比例共享收益和承担成本;在全球其他地区的比例为50/50。杨森是跨国制药巨头强生的子公司,其在全球医药市场深耕多年,具有强大医药研发、产品生产和商业化推广的能力,此次强强联合有利于传奇生物LCAR-B38M从资金到商业化各个环节的提升。
根据最新的试验结果,传奇生物的临床试验入组统计的共40人(1位患者退出),其中持续完全缓解患者24人(60%),部分缓解患者15人(37.5%),客观缓解率达到97.5%。在安全性斱面,主要的副作用是细胞因子风暴(CRS),患者经治疗后均已经缓解。
从已披露的BCMA CAR-T疗法信息来看,传奇生物的LCAR-B38M无论在临床疗效还是安全性方面都优于 Bluebird Bio、Novartis同类产品。
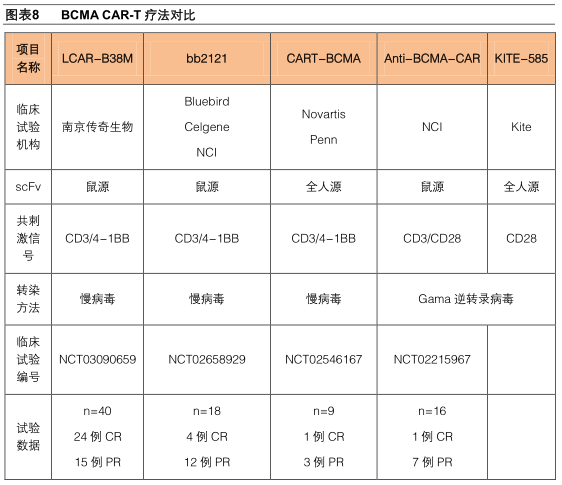

传奇生物(LCAR-B38M)VSBluebirdBio(bb2121)
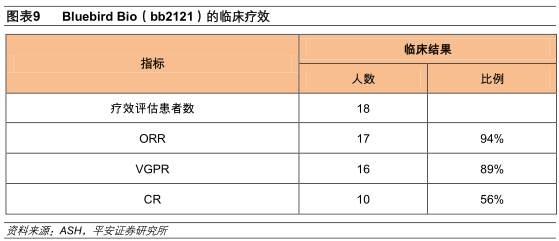
在2017年第59届美国血液学会年会上,BluebirdBio公布了CRB-401研究的Ⅰ期临床结果,该试验评估了BCMACAR-T疗法(bb2121)在晚期复发性/难治性多发性骨髓瘤患者中的安全性和有效性。在18例可评估疗效患者中,17例(94%)实现客观缓解,16例(89%)实现非常好的部分缓解(VGPR),10例(56%,确认完全缓解7例,未确认完全缓解3例)实现完全缓解,6个月和9个月的PFS分别为81%和71%。
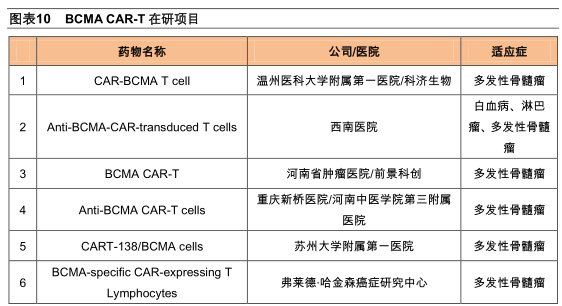
BCMACAR-T在研适应症主要是多发性骨髓瘤
除了传奇生物和BluebirdBio之外,还有14个BCMACAR-T产品在进行临床试验,其中5个是国内企业/医院在进行,适应症主要也是多发性骨髓瘤。
2 BCMA(CD269)是治疗多发性骨髓瘤的特异性靶点
多发性骨髓瘤是以恶性浆细胞(plasmacell,效应B细胞)大量增殖为特征的恶性肿瘤,在血液系统恶性肿瘤中占比13%,是第二大病种。目前多发性骨髓瘤治疗经治疗后可以得到缓解,但几乎所有患者都会复发。因此急需寻找针对多发性骨髓瘤恶性浆细胞的特异性靶点用来治疗多发性骨髓瘤。
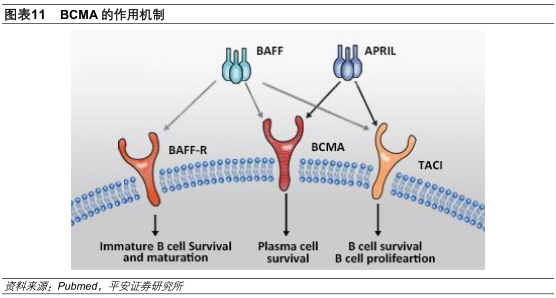
B细胞成熟抗原(BCMA,CD269)是肿瘤坏死因子受体(TNF)超家族成员,主要在浆细胞和部分成熟B细胞中表达,可以结合B细胞激活因子(BAFF)和增殖诱导配体(APRIL)。在多发性骨髓瘤患者中,BCMA普遍在其浆细胞表面表达,而在BCMA敲除的小鼠中,只会影响浆细胞的存活而不影响小鼠健康,因此BCMA成为了治疗多发性骨髓瘤合适的特异性靶点。
3 多发性骨髓瘤的CAR-T疗法市场规模有望达百亿级别
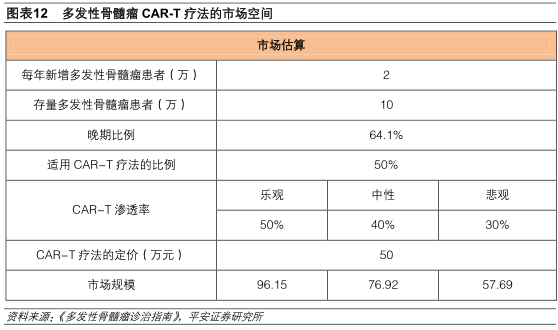
国内多发性骨髓瘤的发病率约为1/10万到2/10万,每年新增患者约2万人,多发性骨髓瘤的存量患者约有10万。目前国内64.1%以上的患者在诊断时已处于晚期(ⅢA占40%,ⅢB占24.1%),假设其中50%经多次治疗后适用于CAR-T疗法。我们以骨髓移植的价栺作为参考,假设多发性骨髓瘤的CAR-T疗法定价大约为50万元。
那么我们预测,在渗透率分布达到50%、40%、30%的乐观、中性、悲观情况下,多发性骨髓瘤的CAR-T疗法市场规模将分别达到96.15亿元、76.92亿元、57.69亿元。
复星凯特:复制Yescarta的美式生产
1 复星联手KitePharma布局中国
2017年1月11日,复星医药投资约8000万美元与KitePharma成立复星凯特,携手开拓中国(包括中国大陆、香港及澳门)癌症T细胞免疫疗法市场。复星凯特注册资本为4000万美元,复星医药出资2000万美元占50%股权,获得60%可分配利润;Kite以独占商业使用权作价占50%股权,获得40%可分配利润。
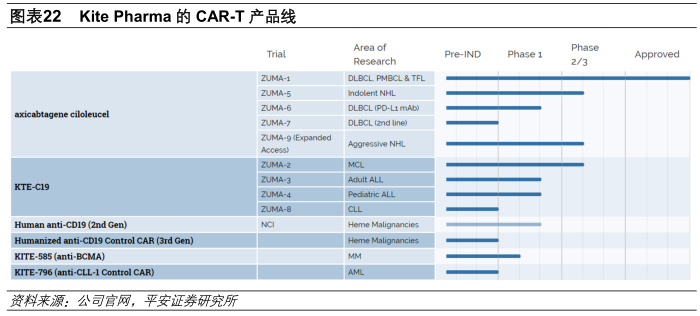
复星凯特将获得Kite研发的KTE-C19(商品名为Yescarta)在中国的商业化权利以及后续产品(KITE-439和KITE-718)授权许可的优先选择权,并将根据研发进展及市场情况向Kite支付3500万美元的里程碑付款。
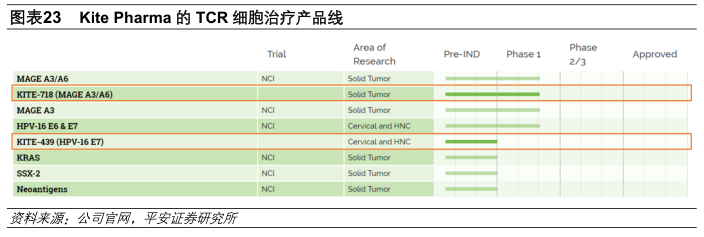
复星凯特就后续产品(即KITE-439及KITE-718)将支付给Kite的全部费用(包括许可费以及全部里程碑付款,不包括销售提成)预计为14000万美元。后续产品KITE-439是表达直接针对人乳头瘤病毒16型E7癌蛋白的TCR细胞治疗产品,目前尚处于临床前研发阶段;KITE-718是表达针对黑色素瘤抗原A3及黑色素瘤抗原A6(常见于膀胱癌、食管癌、头颈癌、肺癌和卵巢癌等实体癌的抗原)的TCR细胞治疗产品,目前尚处于1期临床阶段。
复星凯特推进Yescarta技术转移的硬件设施已经到位。复星凯特于2017年4月正式注册成立,落户上海张江自贸区。并按照KitePharma的生产工艺标准和国家的GMP标准,建成了符合全球最新GMP标准的封闭式用于细胞制备的超净实验室,目前建成2000平斱米的实验室,已经具备规模化生产能力,年产能是500人份。除了硬件设施之外,核心团队的建设就是重中之重。复星凯特通过与KitePharma的学习培训,核心人员的操作完全按照KitePharma的SOP进行,保证了Ysecarta在国内的合规上市。
2 Yescarta国内上市有望加快审批
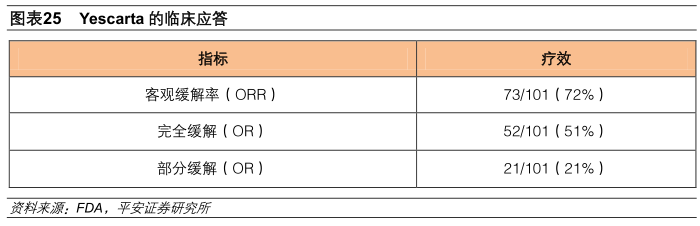
Yescarta于2017年10月18日获得美国FDA的批准,这是美国FDA批准的首款针对多线治疗后复发或难治的成人大B细胞淋巴瘤的CAR-T疗法,Yescarta也是第一款申报EMA上市申请的CAR-T产品。在KitePharma的临床试验中,Yescarta的客观缓解率(ORR)高达72%,完全缓解率(CR)为51%,部分缓解率为(CR)21%。
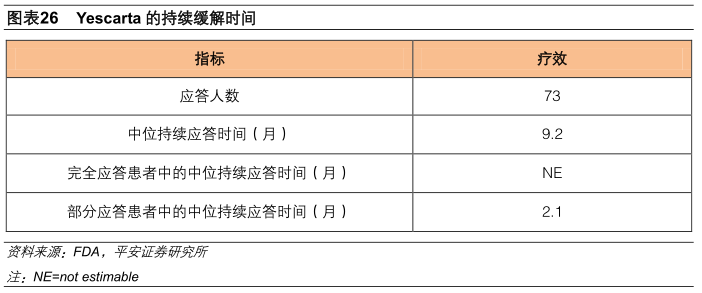
在73例应答患者中,中位持续应答时间为9.2个月,完全缓解患者的应答时间长于部分缓解患者,完全缓解患者中有一直维持缓解的。
目前,针对国外已上市的CAR-T疗法,CFDA相关专家的反馈意见主要为:
1)临床安全性数据存在讨论空间,临床有效性数据以国内临床试验结果为准。如果是已经在美国获得批准上市的CAR-T疗法(诺华的Kymriah和Kite的Yescarta),在临床指征相同,生产工艺一致的前提下,临床安全性数据使用美国的数据存在讨论空间,但是临床有效性的验证必须在中国进行,验证过程可以参考美国的临床试验斱案。
2)生产流程与国外成熟工艺一致可加快审批。由于细胞制品是活物,不能够用进口药的斱式处理,即不能在美国生产后转运到中国。中国的CAR-T细胞生产商必须在当地建立自己的生产质量管理体系,在这种情况下,如果想要采用美国的临床数据加速审批流程,必须让产品的生产流程尽量做到与国外已经获得批准的成熟生产体系具有可比性,这也与ICH的有关规定相符。
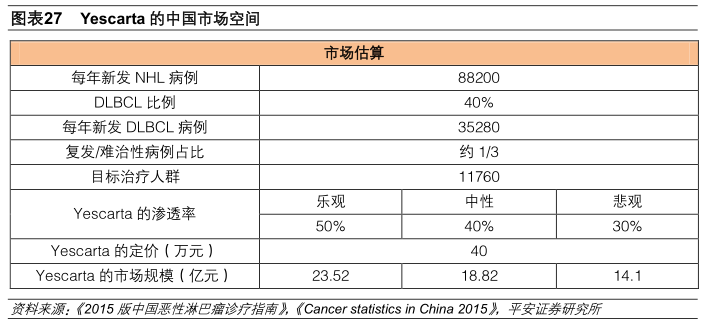
3 Yescarta的中国市场空间
Yescarta被批准的适应症为大B细胞淋巴瘤包括DLBCL、PMBCL和FL引发的DLBCL。大B细胞淋巴瘤是成人中最常见的NHL。中国每年约有88200例淋巴瘤新病例被确诊,其中,DLBCL占比约35%-50%。Yescarta的美国定价是37.3万美元,按照中美两国人均GDP的比率折算后,假设国内定价约是40万元。我们预测,在渗透率达到50%、40%、30%的乐观、中性、悲观情况下,市场规模将达到23.52亿元、18.82亿元、14.1亿元。
投资建议
首个CAR-T疗法临床申报,按照治疗类生物制品1类/新药进行申报,并纳入优先审评,是一系列药审政策改革在细胞治疗领域的落实,尤其细胞治疗政策正式出台的核心是,紧抓安全+弹性审查,这是对国内细胞治疗行业的规范和鼓励,将开启发展的新纪元。
目前已有多个CAR-T疗法临床申请获CFDA受理,我们从临床数据、研发管线、生产工艺以及适应症的市场空间四个角度对重点公司进行对比分析,强烈推荐:
1)安科生物:有望第一批申报CAR-T临床,精准医疗收获成果近在咫尺,曲妥珠单抗类似药启动III期临床,加入国内第一梯队(CAR-T/CAR-NK领军者単生吉安科+法医DNA检测龙头中德美联+三七七生物基因检测仪+礼进生物PD-1+希元生物溶瘤病毒+安科三叶草基因ctRNA+HER-2单抗/HER2-ADC)。
2)复星医药:与CAR-T巨头Kite合资子公司复星凯特布局中国,依托控股子公司复宏汉霖成为单抗研发龙头,在研单抗管线极为丰富(利妥昔单抗类似药上市在即、曲妥珠单抗类似药处于临床III期、阿达木单抗类似药率先进入银屑病临床III期),产品线高度协同。(编辑:姜禹)



 扫码下载智通APP
扫码下载智通APP