Bcl-2抑制剂APG-2575治疗AML患者数据更新 联合AZA疗效和安全性良好
亚盛医药(06855)今日宣布,公司已在第60届美国临床肿瘤学会(ASCO)年会上,以壁报展示形式公布了Bcl-2抑制剂APG-2575联合阿扎胞苷(AZA)治疗初治(TN)或复发/难治性(R/R)急性髓性白血病(AML)患者的Ib/II期临床研究的最新数据。
一年一度的ASCO年会是全球肿瘤领域最重要的、最为权威的学术交流盛会,将展示当前国际最前沿的临床肿瘤学科研成果和肿瘤治疗技术。今年是亚盛医药连续第七年亮相ASCO年会,作为日益活跃在国际学术舞台上的"中国声音",此次公司共有3个原研品种的4项研究入选,其中1项获口头报告。
此次展示的APG-2575联合AZA治疗AML患者的临床研究数据体现了该联合疗法在老年/不耐受标准诱导化疗的TN AML患者以及R/R AML患者中的卓越疗效。此外,肿瘤溶解综合征(TLS)方面的安全性、较低的发热性中性粒细胞减少发生率、以及较低的早期死亡率都展现出该联合疗法良好的安全性特征。
金洁教授
该项临床研究的主要研究者
浙江大学医学院附属第一医院
“APG-2575作为具有完全独立知识产权的新型Bcl-2抑制剂,反应率方面和国外同类产品相似,安全性显示出明显优势。安全性优势带来的更少的治疗相关死亡、更少的剂量调整、更及时的后续化疗疗程,有望对AML患者的长期生存产生促进作用。
王华锋博士
该项临床研究的报告人
浙江大学医学院附属第一医院
“Bcl-2抑制剂是AML治疗领域的重要突破,但是国外同类产品的血液学安全性问题对Bcl-2抑制剂的临床广泛应用和远期疗效方面存在不利影响。作为本土创新药物的优秀典范,APG-2575屡次在国际学术大会上发光发热。APG-2575和化疗联合使用中,血液学不良反应的发生率较国外同类产品为低;更关键的是,血液学不良反应程度轻,易于控制和处理。血液学毒性相关的其它严重事件如发热性中性粒细胞减少、30d/60d内死亡率非常低,充分说明APG-2575的血液学毒性程度轻、持续时间短、严重程度低、易于控制且对后续化疗疗程的影响小。在安全性方面,APG-2575已经展现出优于国外同类产品的临床潜力。”
翟一帆博士
亚盛医药首席医学官
“此次展示的APG-2575联合AZA治疗AML患者的疗效和安全性数据令人欣喜,这不仅再次佐证了该品种的全球‘Best-in-class'潜力,也进一步表明APG-2575有望为AML这一常见且预后极差的血液肿瘤领域带来新的治疗希望。值得一提的是,目前已有一项该品种治疗AML患者的全球注册III期临床正在开展,我们将坚守‘解决中国乃至全球患者尚未满足的临床需求'这一使命,加快临床开发。期待在不远的将来,APG-2575这一中国原创药物能够惠及广泛的AML患者。”
在此次ASCO年会上展示的该临床研究核心要点如下:
Safety and efficacy of lisaftoclax, a novel BCL-2 inhibitor, in combination with azacitidine in patients with treatment-naïve or relapsed or refractory acute myeloid leukemia.
新型Bcl-2抑制剂APG-2575(Lisaftoclax)联合阿扎胞苷治疗初治或复发/难治急性髓性白血病患者的有效性和安全性
摘要编号:6541
分会场标题:血液肿瘤——白血病,骨髓增生异常综合征及异基因造血干细胞移植(Hematologic Malignancies—Leukemia, Myelodysplastic Syndromes, and Allotransplant)
报告时间:
2024年6月3日星期一9:00 – 12:00(美国中部时间)
2024年6月3日星期一22:00 – 次日凌晨1:00(北京时间)
第一作者:王华锋博士,浙江大学医学院附属第一医院
核心要点:
研究背景和研究介绍:早期研究显示,在AML中,APG-2575联合多种药物有协同诱导细胞凋亡的作用。本次会议报告一项探索APG-2575联合AZA在成年AML患者中的安全性和有效性的Ib/II期研究的随访数据。
入组患者和研究方法:
该研究入组的患者为老年(≥75岁)/不耐受标准诱导化疗的TN AML患者,或R/R AML患者(≥18岁)。APG-2575每天口服一次(400/600/800mg),28天为一个治疗周期,在第一个治疗周期中,APG-2575采用每日剂量递增方案以预防TLS;75mg/m2的AZA于D1-7每天给药一次。
截至2024年1月25日,已入组76例AML患者,其中37例为R/R AML患者;39例为老年/不耐受标准诱导化疗的TN AML患者。中位年龄66岁(范围,20-81)。
疗效数据:
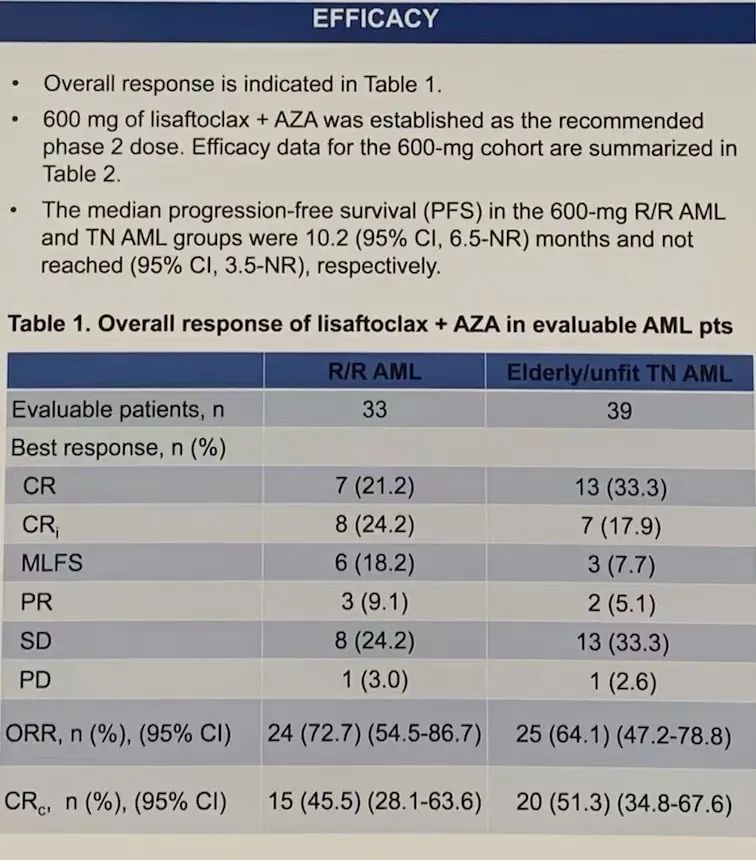
在所有经APG-2575联合AZA治疗的R/R AML患者中,总体反应率(ORR= CR + CRi + 形态学无白血病状态[MLFS] + PR)为72.7%,复合完全缓解率(CRc = CR+ CRi)为45.5%。600mg剂量组(n=30)的中位治疗持续时间为3.8个月,ORR为76.7%,CRc为50.0%;达到CRc的中位时间为2.5个月;中位PFS为10.2个月;中位总体生存期(OS)为14.7个月。
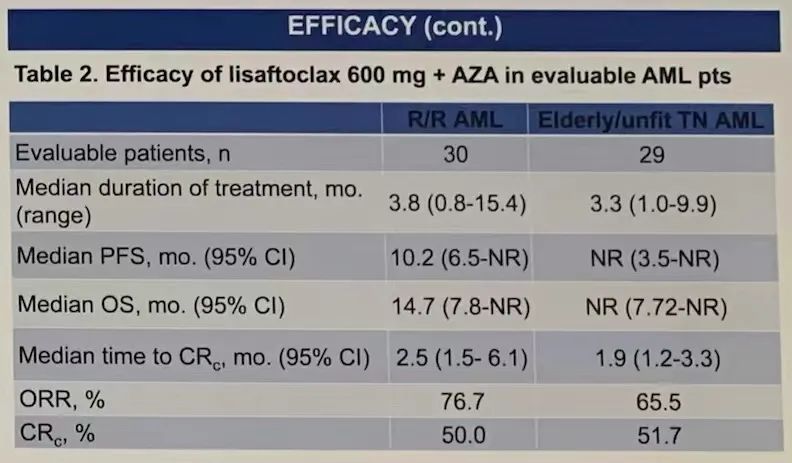
所有经APG-2575联合AZA治疗的TN AML患者中,ORR为 64.1%,CRc为
51.3%。600mg剂量组(n=29)的中位治疗持续时间为3.3个月;达到CRc的中位时间为1.9个月;尚未达到中位PFS和中位OS。
600mg APG-2575被选定为联合AZA治疗AML的II期研究推荐剂量(RP2D)。
安全性数据:所有患者均经历了治疗期间出现的不良事件(TEAEs),其中3/4级TEAEs发生率为89.5%,严重不良事件(SAEs)发生率为43.4%。常见的(≥10%)3级及以上的TEAEs包括中性粒细胞减少(57.9%)、血小板减少(50.0%)、贫血(27.6%)、肺炎(17.1%)和中性粒细胞减少伴发热(10.5%)。未报道任何TLS事件。30天死亡率为1.3%。
结论:本研究数据体现了新型Bcl-2抑制剂APG-2575联合AZA在老年/不耐受标准诱导化疗的TN AML患者以及R/R AML患者中的潜力,特别是展示了TLS方面的安全性、中性粒细胞减少伴发热发生率较低,以及较低的早期死亡率。目前已有一项随机双盲的III期研究正在开展,将进一步探索APG-2575联合AZA在老年/不耐受标准诱导化疗的AML患者中的生存获益。
本文转载自“亚盛医药”微信公众号,智通财经编辑:刘家殷。



 扫码下载智通APP
扫码下载智通APP